Введение в химическую технологию №3
Третья, заключительная часть - продолжение двух первых частей. В ней пойдет речь о способе очистки веществ, экстракции и кристаллизации.
Частичная экстракция
Экстракция - способ извлечения вещества из раствора с помощью подходящего растворителя, который не смешивается с раствором (либо растворимость сверхнизнакая), но в котором вещество растворяется лучше, чем в первом растворителе. В экстракции используются триптиховые диаграммы.
Триптиховые диаграммы показывают три компонента при постоянной температуре (iso-T). Принцип диаграммы заключается в том, что каждая вершина треугольника, A, B, C это чистое вещество, точка P смесь трех веществ, XAP, XBP и XCP представляют соответствующие части массы A, B и C в системе.
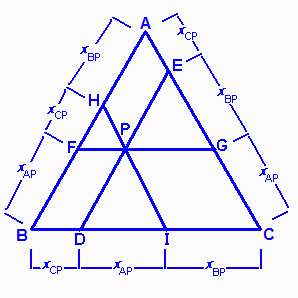
Соответственно:
XAP = DI/BC = BF/BA = GC/AC
XBP = IC/BC = HA/BA = EG/AC
XCP = BD/BC = FH/BA = AE/AC |
|
XAP = DI = BF = GC
XBP = IC = HA = EG
XCP = BD = FH = AE |
Например, надо разделить смесь из двух веществ А и В образуюшие одну фазу раствора на входе F с помощью третьего вещества С (вход S). На выходе М смогут появиться две фазы лишь в том случае, если точка М будет внутри дуги.
 
F + S = M
Для нахождения М достаточно знать одно из веществ i.
Xi,FF + Xi,SS = Xi,MM
По отношению F и S можно найти точку М:
F(Xi,F-Xi,M) = S(Xi,M-Xi,S)
F/S = (Xi,M-Xi,S)/ (Xi,F-Xi,M)
В случае если М внутри дуги, то есть разделение на экстракт и рафинат.
Экстракт (extract) - исчерпывающая фаза, в которой большая часть нужного нам вещества.
Рафинат (rafinat) - остаток.
Фаза равновесия между R и Е (способы нахождения)
I. Когда нам дана диаграмма с разными равновесиями, то с помощью интерполяции* можно найти нужный нам R и E, в случае если они не указаны на диаграмме.

II. При использовании диаграммы с прямым углом. С помощью данных можно начертить соединяющую линию на которой будут линии узлов. И далее добавить данные R и Е.
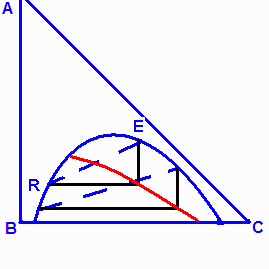
III. Селективная диаграмма. Если нам дан определённый R, то мы проводим прямую до линии в 45°, под углом 90°, затем проводим линию вверх и в том месте, где будет соприкосновение с дугообразной линией, проводим прямую в обратную сторону. Где прямая коснется дуги диаграммы, там будет наш E.

Связь между линиями FC и RE будет точка М.
Постоянная экстракции

В постоянной экстракции требуется меньше растворителя, из-за более лучшего(так не говорят…*из-за улучшенного…из-за более совершенного…или просто лучшего) перемешивания, а также градиент перехода вещества становится лучше, в том случае, когда поток направлен в противоположные стороны. Система постоянной экстракции - количество N колонн в виде труб. Каждая колонна равняется единицей частичной экстракции.
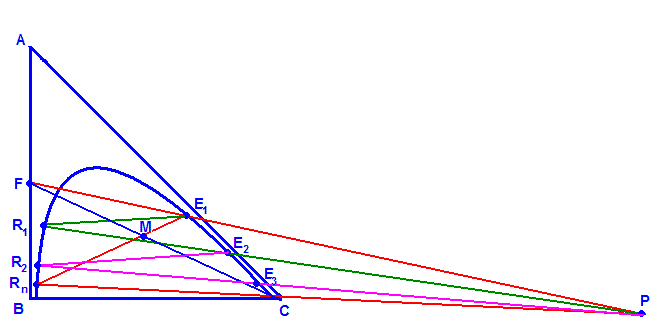
Этапы расчёта постоянной экстракции:
I. Указываем на триптиховой диаграмме данные нам точки F, C и Rn.
II. По соотношению F/C найдем точку M.
III. Соединяем точки M и Rn и получаем точку E1.
IV. Проводим линии F-E1 и Rn-C до тех пор пока они не встретятся за диаграммой в точке P.
V. Из E1 с помошью вспомогательных линий находим R1.
VI. Соединяем R1 и P, в том месте где линия сприкасается с дугой будет E2.
VII. Из E2 с помошью вспомогательных линий находим R2.
VIII. Заканчиваем процесс тогда, когда наш R будет меньше или равен Rn.
Кристаллизация
Кристаллизация это способ получения твердого вещества. Чтобы произошла кристаллизация, добавляют другое вещество, хорошо растворимое, до тех пор, пока нужное нам вещество не выпадет в осадок в виде кристаллов. Такой способ называется SaltingOut.
Другой способ кристаллизации - выпаривание растворителя и изменение температуры, которая изменяет растворимость. Во многих случаях это охлаждение раствора, но есть некоторые вещества, где наоборот нужно поднять температуру.
Эвтектическая диаграмма фаз - бинарная система

Вы можете посмотреть также диаграмму кристаллизации A+B стр.75
Когда мы находимся в зоне раствора, нет осадков. По мере понижения температуры или изменения концентраций выпадет осадок в растворе. Температура - это наиболее подходящий метод с энергетической точки зрения. Её понижение ниже точки насыщенности приводит к появлению двух фаз:
Для того чтобы найти количество выпавшего осадка (вещества A+B): мы определяем осадок по Х-шкале.
br>F = Solid + Liquid
XAF*F = XAS*S + XAL*L
а также:
S/L = LF/SF
В реальности в кристаллах осадка всегда есть немного воды. Также есть гироскопические вещества, которые способны присоединять к себе молекулы воды, например CaSO4. Для полного удаления воды, необходимо нагревание кристаллов в печи, либо сухим горячим воздухом.
Триптиховая диаграмма тринарной системы (Na2C03-Na2SO4-H2O)

Существуют разные триптиховые диаграммы тринарной системы. Для примера мы рассмотрим раствор Na2C03-Na2SO4-H2О стр.83.
Диагональные красные линии показывают температуру насыщенного раствора. Красная вертикальная линия AB для двух веществ показывает растворимость при разных температурах. Левые линии от AB указывают на раствор Na2C03 без насыщенности Na2SO4. Правые линии AB указывают на раствор Na2SO4 без насыщенности Na2C03. Точки D и C указывают на гидраты солей - в точке D процент Na2C03 в гидрате равен 37.1%, а в точке C процент Na2SO4 равен 44.1%., а в точке B (Na2C03 - 18.2%, Na2SO4 - 15.9%, H2O - 65.9%) раствор насыщен двумя солями одновременно, т.е. под этой точкой будет осадок в виде гидратов двух солей: Na2C03*10H2O и Na2SO4*10H2O
Растворимость (H2SO4-H2O)
Растворимость веществ делится на две основные категории. Первая - хорошо растворимые вещества друг в друге и вторая – плохо растворимые. Например, этиловый спирт растворим в воде в любых отношениях, а бензин в воде не растворяется вообще. Кроме того, растворимость сопровождается выделением или поглощением тепла. Все зависит от состава самого вещества.
Существуют различные диаграммы по растворимостям веществ и сопровождению тепла. В данном случае рассмотрим диаграмму энтальпии серной кислоты-воды от 32°F в атмосферном давлении. Как известно нельзя вливать воду в концентрированную серную кислоту, потому что при растворении ее в воде происходит очень сильное нагревание.
В нашем примере диаграмму можно поделить на три части: нижняя, верхняя и последняя верхняя дугообразная линия ("колокол"). В нижней части есть только одна жидкая фаза. "Колокол" и верхняя части обозначают насыщенный раствор, Они делятся на жидкую и газообразную фазу. Газообразная фаза обогащена парами воды, и поэтому пары кислоты можно приравнять к нулю, а в жидкой фазе конечный процент кислоты будет выше начального.
Техническая термодинамика
Закрытая система: Q-W=∆U+∆Ek+∆Ep+∆Hr
Открытая система: Q-W=∆H+∆Ek+∆Ep+∆Hr
Где:
Q - тепло (выходящее с минусом, входящее с плюсом)
W - работа (выходящая с плюсом, входящая с минусом)
∆U - внутренняя энергия
∆H - энтальпия
∆Ek - кинетическая энергия
∆Ep - потенциальная энергия
∆Hr - реакционная энтальпия
Энтальпия: ∆H=n*Cp*∆T
Реакционная энтальпия: ∆Hr=n*Hf/c
Таблицы тепла газов (Cp): 86, 88 (относительно 25°C).
Таблицы тепла образования неорганических веществ (∆Hr=n*Hf): Ac-Ca, Ca-Hy, Hy-Ma, Me-Po, Po-Zi стр.93-97.
Таблицы тепла горения органических веществ (∆Hr=n*Hc): гидрокарбоны, алкоголи, кислоты, карбогидраты, другие CHO, нитро-, галогено-, сульфокарбоны стр.98-100.
Лит-ра: Felder, R. M. and Rosseau, R. W., "Elementary Principles of Chemical Processes”, 3d Ed., J.Wiley & Sons, New York (1999);
Himmelblau, D. M., "Basic Principles and Calculations in Chemical Engineering”, 6th Ed., Prentice-Hall, New Jersey (1996).
*Интерполяция - вычисление точки (x,y) между двумя данными точками (x1 ,y1) и (x2 ,y2), когда неизвестен только x или y.
Расчёт производится по формуле: y-y1=[(y2-y1)/(x2-x1) ]*(x-x1 )
|













