Введение в химическую технологию №2
В данном разделе речь пойдет о связи между объёмом (V), давлением (P) и температурой (T).
Существуют 3* основные фазы, в которых вещество может находиться:
Твердая фаза - в данной фазе частицы вещества находятся в определённом порядке, который преобразует структуру определённой решетки.
Жидкая фаза - в данной фазе, в отличие от твердой фазы, частицы вещества находятся в полном хаосе, однако, существует между ними определённая межмолекулярная связь, не дающая им, отделятся друг от друга.
Газовая фаза - фаза, в которой частицы вещества находятся в полном беспорядке и удалены друг от друга на большом расстоянии. Какой-либо межмолекулярной связи между ними не существует. Газовое состояние вещества имеет наибольший объем по сравнению с двумя предыдущими фазами.
Существует определённая связь между давлением и температурой. Например, чем выше давление, тем выше температура кипения и наоборот.
График фазы чистого вещества
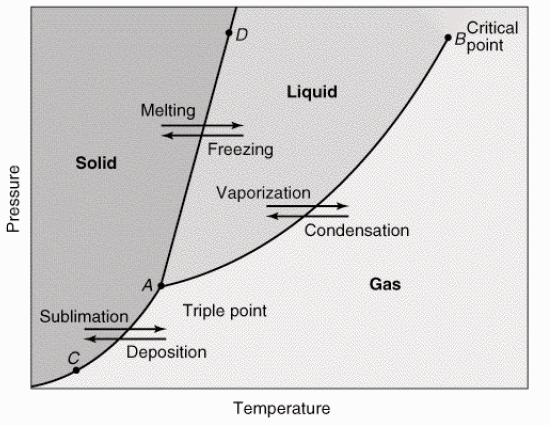
Tp - точка где вещество находится сразу в трех фазах одновременно.
Супер критическая точка - вещество находится в жидком и газовом виде одновременно.
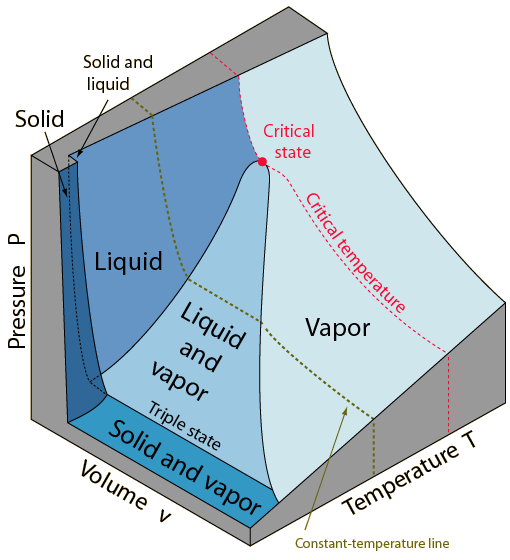
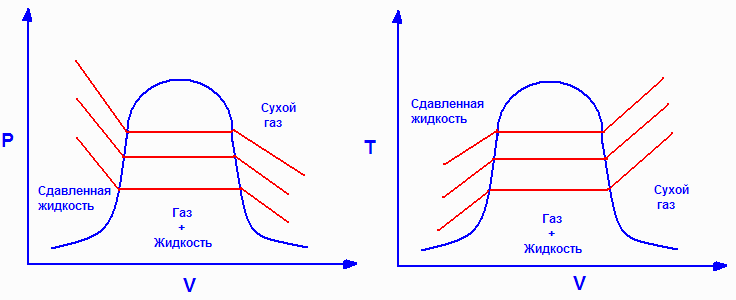
"Качество" (X) - сушествует только внутри колокола, где сушествует газовая и жидкая фаза отновременно. Если X=0, то это насыщенная жидкость, если X=1, то это насыщенный газ. Получение "качества":
X = mg/(mg+ml) = (Vx-l )/(Vg-Vl)
mg - масса газовой фазы
ml - масса жидкой фазы
Vx - Специфический объём "качества"
Vl - Специфический объём в жидкой фазе
Vg - Специфический объём в газовой фазе
Давление паров (P°) - над каждым неорганическим или органическим веществом в жидком или твердом состоянии в зависимости температуры и давления существует определенное давление (упругость) пара. Упругость пара определяет количество молекул, отрывающихся от поверхности вещества. Если давление пара того или иного вещества равно внешнему давлению, т.е. атмосферному, то вещество кипит. Таким образом, при температуре кипения давление пара равно внешнему давлению.
I.Уравнение Клаузиуса-Клаперона (Clasius-Clapeyron):
Ln(P°2/P° 1) = ∆Hevp/R*(1/T 1 - 1/T2)
Где:
P°- давление паров
T - температурa
∆Hevp - тепло выпаривания
R = 8.31[J/mol*K]
∆Hevp = 1.093*R*Tcritical*[Tbr(LnPc-1)*(0.93-T br)]
Tbr = Tboiling/Tcritical
II.Уравнение Антуана:
LogP° = A + B/(C+T)
Где:
P°- давление паров [mmHg]
Т - температура в цельсиюсах [°C]
А, B, C - параметры из таблицы: 37 веществ + Архив с данными [2Mb]
Данные воды:
0-Т°C-60 :А=8.10765; B=1750.287; C=237
60-T°C-150 :А=7.96681; B=1668.21; C=228
∆H2/∆H1 = (1-Tr2/1-Tr1 )
(Tr=T/Tc )0.38
Бывают случаи, когда не даны критические данные вещества, такие как: температура, давление и объем. В этих случаях их можно вычислить по определённым уравнениям.
III.Уравнение критической температуры
Таблицы вычисления: стр.24, стр.25, стр.26.
IV.Уравнение критического давления
Таблицы вычисления: стр.27, стр.28.
V.Уравнение критического объёма
Таблицы вычисления: стр.29, стр.30.
Критические параметры веществ - не рабочая ссылка!
Исправленные параметры у водорода и гелия:
Tca = Tc + 8[K]
Pca = Pc + 8[atm]
Идеальный газ
Когда речь идет о жидкостях или твердых веществах, то при изменении температуры или давления, их параметры не очень изменяются, что нельзя сказать о газах.
Идеальный газ - одноатомные сферические молекулы с объёмом который стремится к нулю, интеракции и взаимные столкновения эластичны. В реальности уравнение идеального газа не всегда работает, т.е. при решении определённой задачи с газами, мы получим результаты с ошибками. одноатомные сферические молекулы с объёмом, который стремится к нулю (P -> 0), интеракции и взаимные столкновения эластичны. В реальности уравнение идеального газа не всегда работает, т.е. при решении определённой задачи с газами, мы получим результаты с ошибками. Когда давление стремится к нулю, P -> 0, можно сказать что газ идеальный. Большинство молекул, в том числе и органических, при таком низком давлении ведут себя как идеальный газ.
PV = nRT
Где:
P - давление газа в атмосферах [аtm]
V - объем газа в литрах [l]
n -кол-во молей газа [mol]
R - постоянная константа 0.082 [(l*atm/mol*К)]
T - температура в кельвинах [K]
Реальный газ
В реальности мы часто сталкиваемся с поведением реальных газов. Уравнение вычисления реальных газов примерно такое же, как и у идеальных, только с добавленным коэффициентом сжатости.
Kоэффициент сжатости (Z) - это то, на сколько плотно можно сжать газ. Если Z=1, то газ считается идеальным, если нет, то он не идеален. Коэффициент сжатости зависит от вида вещества, и уравнения в условиях системы Z=f(P,T)
PV = ZnRT
Где все параметры как и у идеального газа. Исключение Z - без параметров.
Способ нахождения Z по графикам.
В основном это графики измерений без каких-либо параметров. "Мир" где все газы ведут себя одинаково. Для работы с такими графиками необходимо перейти в температуру и давление без каких либо параметров.
Температура:
T/Tc = Tr
Где:
Т - данная температура
Tc - критическая температура
Tr - температура из графика
Напомню, что деление происходит только с абсолютными температурами (кельвин на кельвин, цельсиюс на цельсиюс).
Давление:
P/Pc = Pr
Где:
P - данная температура
Pc - критическая температура
Pr - температура из графика
У большинства газов Zc равняется около 0.27 (Zc=0.27), после чтения графиков находим нужный нам Z с помощью следуюшего уравнения:
Z = Zc + D*(Zc - 0.27)
Где:
Zc - критический коэффициент сжатости (Tr, Pr).
D - исправление (Tr, Pr, Zc)
Графики: Z, Правка Z.
Смесь идеальных и реальных газов.
Когда речь идет о смеси идеальных газов, то это можно допустить как один идеальный газ.
Когда же речь идет о смеси реальных газов, то надо найти коэффициенты сжатости каждого газа, объемы, и только тогда сложить вместе, в том случае, когда есть интеракции между газами.
Коэффициент сжатости смеси реальных газов можно найти по молярному составу (Xi):Z = ΣXi*Zi (Zi - kоэффициент сжатости, Xi - молярный состав, P - суммарное kоэффициент сжатости), кстати очень похожему на уравнение Дальтона: Pi = Yi*P (Pi - частичное давление, Yi - молярный состав, P - суммарное давление).
Равновесия
I. Жидкость - жидкость:
В зависимости от действующих связей межмолекулярных между жидкостями, есть несколько возможностей:
а) идеальное растворение, например, гексан в октане
б) частичное растворение, например, ацетон в хлороформе
в) отсутствует растворения, например, масло в воде
Фазовый график бинарной системы - показывает температуру кипения раствора в зависимости от количества долей растворителя и растворенного вещества. Внутри колокола существуют растворы в двух фазах, в то время как снаружи только в одной. Пик колокола обозначает одну однородную фазу (UCST - up critical saturated temperature).
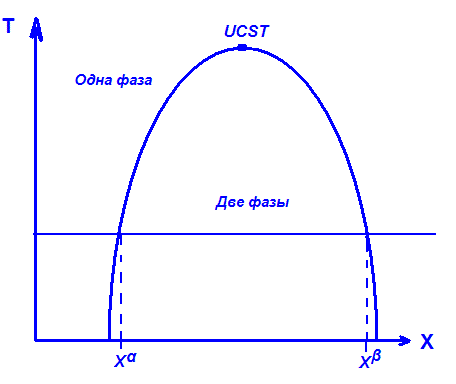
Xα и Xβ- - фазы, где почти не сушествует растворимость двух веществ.
У большинства веществ существует примерно такой график. Однако, есть исключения, когда колокола перевернуты. У них нижняя точка LCST (Low critical saturated teperature). Пoмимо этого существуют и другие графики, напримeр, растворимость никотина в воде имеет яйцеобразную форму, когда внутри при определённых долях существуют две фазы, а снаружи только одна.
II. Жидкость - твердое вещество:
Как и в случае с жидкостями, твердые вещества также имеют три вида возможностей раствора:
а) идеальное растворение, например, поваренная соль в воде
б) частичное растворение, например, мел в воде
в) отсутствует растворения, например, золото в воде
Эвтектический график - показывает температуру кипения раствора в зависимости от количества долей растворителя и растворенного вещества. В данном случае нижняя часть графика это смесь твердых веществ, далее - выше зона раствора и твердого вещества. Полоса показывает на насыщенность раствора и выше полосы есть зона раствора.
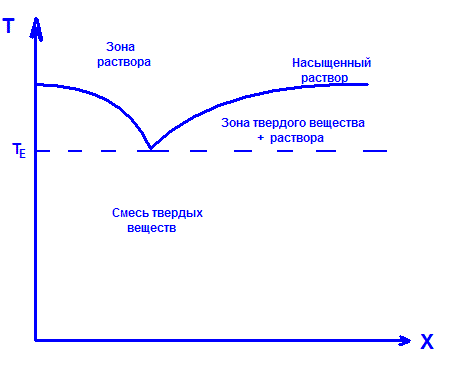
TE - Эвтектическая зона, где все вещества находятся в виде твердых веществ.
( Эвтектика)
III. Жидкость - газ:
Над каждой жидкостью есть пары. При растворах двух или более жидкостей, всегда над жидкой фазой, есть смесь паров этих жидкостей.
Бинарный раствор - раствор из двух жидкостей, которые либо идеально растворяются, либо частично, либо совсем отсутствует растворимость. Когда две жидкости не растворяются одна в другой, то суммарное давление паров будет равно давлению паров первого и второго вещества.
Pt = PA°+PB°
Если между двумя веществами есть между молекулярные интеракции, то, как правило, суммарное давление паров будет равно составу газа.
Pt = XAPA°+ XBPB°
1.Идеальный раствор.
В идеальном растворе нет разницы между веществами. Молекулы двух веществ одинаковые по свойствам интеракций, представляют собой одно вещество,
XiP°i = YiPt
Xi - доля вещества в жидкой фазе
Yi - доля вещества в газовой фазе
X1 + X2 = 1
Y1 + Y2 = 1
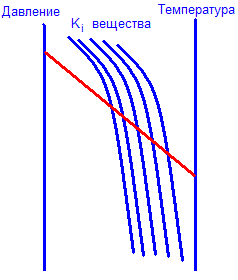
2.Неидеальный раствор.
На неидеальные растворы не действуют законы Рауля - Дальтона. Как и в неидеальных газах, нужен фактор исправления:
Kоэффициент деления - Кi=Yi/Xi или относительная испаряемость - αi=Yi/Xi
Графики коэффициентов деления: первый (стр.31) и второй(стр.32).
Использование графиков: проводим линию между данной температурой и давлением и находим Кi нужного нам вещества.
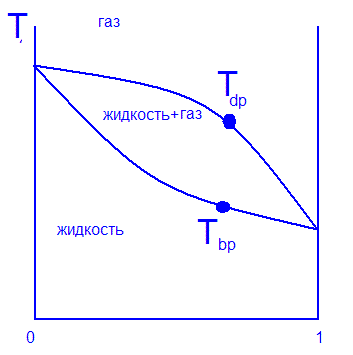
3.Точка пузыря Tbp (Booble point) - температура появления пузырьков паров жидкости при кипении. Состав газа изменяется, состав жидкости остается прежним.
4.Точка росы Tdp(Dew point) - температура появления капель паров при конденсации. Состав жидкости изменяется, состав газа остается прежним.
5. Постоянная Генри - используется в основном, когда растворимость газа в жидкости очень мала, X<0.5%. Закон генри гласит:
Pi = H*Xi или Pi = H*Ci
Где:
H - постоянная Генри
Pi - давление газа в жидкости
Xi - доля газа в жидкости
Ci - концентрация газа в жидкости
График постоянных Генри (стр.34) - растворимость газов в воде [atm-1].
Например, какова постоянная Генри у брома при температуре воды 60°C?
Решение:
1/H = 4*10-3 [atm-1]
H = 1/4*10-3 = 250 [amt]
Влажность
1.Влажность - пары жидкости в газовой среде, т.е. количество испаряемого газа и количество несущего газа. Несущий газ всегда в постоянном количестве, количество испаряемого газа меняется в среде несущего газа, лишь в том случае когда речь идет о смеси идеальных газах, или в очень малых давлениях. У каждой смеси есть своя температура - влажная и сухая.
2.Сухая температура (Td) - температура испаряемого и несущего газа вместе.
3.Влажная температура (Tw) - температура росы (Tdp), то есть когда несущий газ насыщен (до 100% влажности) испаряемым газом. При перенасыщении несущего газа испаряемым мы получим конденсацию паров.
4.Молярная влажность: H = n испаряемый газ/n несущий газ
5.Массовая влажность: W = m испаряемый газ/m несущий газ
Отсюда: H* Mw испаряемый газ/Mw несущий газ = W ,
а также: H = [PV/RT]испаряемый газ/[PV/RT]несущий газ = P испаряемый газ/P несущий газ.
Pt = P испаряемый газ + P несущий газ .
6.Процент влажности: %H = [H/H(sat)]*100% (sat - насыщеный)
7.Относительная влажность: HR = P испаряемый газ/ P° испаряемый газ
8.Адиабатический процесс - изменение сухой температуры без утечки тепла.
Небольшое обьяснение адиабатического процесса на англиском языке: Adiabatic_Mixing [83kb]
Лит-ра: Felder, R. M. and Rosseau, R. W., "Elementary Principles of Chemical Processes”, 3d Ed., J.Wiley & Sons, New York (1999);
Himmelblau, D. M., "Basic Principles and Calculations in Chemical Engineering”, 6th Ed., Prentice-Hall, New Jersey (1996).
*Вещество может существовать в четвертой фазе - плазма.
Copyright©C2H5OH,2007
|













