Введение в химическую технологию №1
Понятия:
Процесс - ряд действий, приводящих к определённому изменению, изменения которого могут быть как физические, так и химические.
Подача - количество вещества на единицу времени. Основные мощности - массы[W = mass/time ], объёма[Q = volume/time], молей[W = moles/time].
Химический процесс - действие, в котором есть изменение вещества (например, горение метана).
Физический процесс - действие, в котором есть физически изменения (например, кипячение воды).
Подача (feed); вход (input); выход (output); продукт (product); единица процесса (process unit).
Существует три вида процесса:
I. Дольный процесс (Batch process), или процесс порциями. В таком процессе всегда есть определённое количество введёных веществ. В данном процессе есть изменения со временем.
II. Полудольный процесс (Semibatch process). В таком процессе часть веществ вводится постоянно, а часть с промежутками во времени.
III. Постоянный процесс (Continiouos process), процесс в котором нет изменения состава вещества со временем. Положительные качества постоянного процесса - теоретически можно изготовлять бесконечное количество необходимого.
Отрицательные свойства - такой процесс требует особого внимания, чтобы в результате не получить ненужное вещество. В постоянных процессах всегда есть начальная стадия (startup), в коротком отрезке времени. К начальной стадии всегда можно относится как к дольному процессу.
IV. Стойкое состояние (Stady state - st.st.), состояние, когда нет изменения в параметрах. Система в таком положении постоянна, в случае если у нас есть изменения в системе, то процесс уже будет дольный или полудольный.
Закон сохранения вещества: «масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции», то есть ниоткуда не появляется и никуда не исчезает. Исключение из правил - атомные и термоядерные реакции.Массовое количество вещества загружаемого в реактор всегда равно количеству вещества, выходящего из реактора Win=Wout.
Уравнение закона сохранения вещества: «Input+generation-output-consumption=accumulation». То есть «Входящее+возникаемое-выходящее-исчезающее=накапливаемое». В физических процессах, таких как дистилляция, или вакуумная перегонка обычно есть только входящие и выходящие вещества. Если не сказано что есть химическая реакция, остальные компоненты формулы аннулируются.
Виды изменений баланса:
Дифференциальный баланс - точечный в определённом отрезке времени, обычно это постоянный процесс.
Интегральный баланс - показывает изменения со временем в одной точке на другую.
Пример: Подача 1000 kg/h смеси бензола (B) и толуола (T) в реактор, которая содержит 50% B. Смесь разделяется на две фракции, верхняя с выходом в 450 kg/h B, нижняя с выходом 475 kg/h T. Вычислите состав обоих фракций.
Решение:
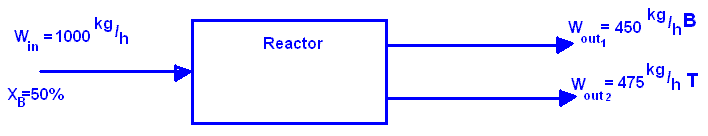
Количество бензола в подаче: 1000*0.5=500 kg/h
Количество толуола в подаче: 1000-500=500 kg/h
Дано что в верхней фракции выход бензола составляет 450 kg/h, значит в нижней фракции будет: 500-450=50 kg/h.
А количество толуола в верхней фракции будет: 500-475=25 kg/h.
Ответ: Верхняя фракция 450 kg/h B(94.7%), 25 kg/h T(5.3%); нижняя фракция 50 kg/h B(9.5%), 475 kg/h T(90.5%).
Возвратный поток (recycle).
Существуют реакции, когда не все реагенты вступили в реакцию, а лишь только их часть. Возвратный поток исходит из определёного реактора и загрузка в реактор делится на две части - первая "свежая загрузка" (fresh feed), и вторая где уже есть как "свежая загрузка", так и часть возвратного потока. Кроме того, поток используется для некоторых реакций, в которых, присутствуют дорогостоящие катализаторы, для разбавления концентрированных смесей и для понижения температуры.
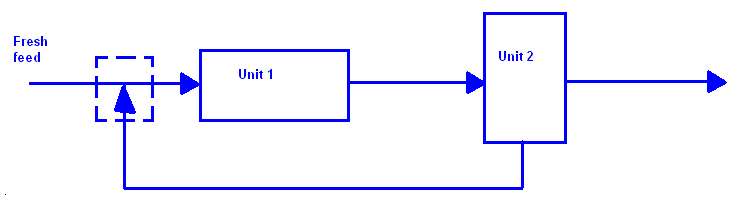
Обгоняемый поток (by pass), используется в случаях, когда надо разбавить выходящие продукты определённого процесса.
Химические реакции должны быть уравновешены, то есть равное отношение в молях между реагентами и продуктами. Например, реакция горения оксида серы в кислороде: 2SO2 + O2 --> 2SO3.
В данной реакции мы видим, что количество молей атомов серы и кислорода в реагентах равно количеству молей в продуктах (2:1:2).
Теоретический все реакции можно назвать стопроценто реагирующими, когда количество молей пропорционально. В реале же бывают случаи когда часть реагентов находится в недостатке, а часть в избытке.
Решение процентов избыточного вещества в выходе. (n-ns/ns)x100%.
Где n - количество загружаемых молей в реактор, ns количество стехиометрических молей в уравнении реакции.
Пример: дано 2 моля H2 и один моль Br2, узнайте какое вещество в избытке?
Решение: Составляем и уравновешиваем реакцию между бромом и водородом H2 + Br2 --> 2HBr.
Смотрим отношение между молями брома и водорода (1:1), но поскольку нам дан не один, а два моля водорода, то водород будет в избытке. Теперь узнаем процент выхода молей водорода [(2-1)/1]х100%=100%.
Обратный процент, процент, показывающий связь между количеством молей, которые среагировали и молями подачи. Вычисляется по формуле nмоли реагируещие/nподачих100%=Х. В основном обратный процент решается по веществу в недостатке.
По молям вещества, которое в недостатке, можно решить отношение между всеми молями в реакции. Например, дан обратный процент и количество молей, которые введены в реактор. Узнаем количество среагировавших молей, и по стехиометрическому отношению узнаем, сколько молей остальных веществ среагировали и сколько молей продуктов образовалось.
Реакции с химическим равновесием.
Такие реакции обычно не протекают стопроцентно, как хотелось бы. А часть продуктов реакции переходят в реагенты. У таких реакциях существует постоянная (К) равная молевым дробям в продуктах делённых на молевые дроби реагентов.
aA+bB↔cC+dD
Изменить такую реакцию, можно с помощью изменения температуры, давления, добавки или отнятия веществ.
Реакции протекающие одновременно.
Как известно, теоретически, хотелось бы, чтоб в реакторе протекала одна определённая реакция, выходом нужного продукта. В реальных реакторах все иначе. При подаче реагентов, могут происходить как одна, так две и более реакций, причем большинство их не нужны.
Например, при дегидрогенации этана в этилен, получается водород, который реагирует с этиленом в получении метана, а сам этилен с этаном в получении пропилена и метана.
I. C2H6 → C2H4 + H2
II. C2H6 + H2 → 2CH4
III. C2H6 + C2H4 → C3H6 + CH4
В таких реакциях обратный процент НЕ ОБЯЗАТЕЛЕН! А вот коэффициент полезного действия (yield) важен. А вот коэффициент полезного действия (yield) важен. Коэффициент полезного действия - это отношение между количеством молей, которые получили и молями, которые мы БЫ получили, ЕСЛИ БЫ не было дополнительной реакции, и весь реагент в недостатке среагировал.
Вычисляется по формуле:
| nмолей которые получили |
| nкоторые мы БЫ получили ЕСЛИ БЫ не было бы дополнительный реакции и весь реагент в недостатке среагировал |
|
= |
yield |
I. Селективность (selectivity)- отношение между количеством молей с выходом нужного продукта и выходом общего числа молей ненужных продуктов (включая нужный продукт).
| nмолей нужного продукта |
| nмолей ненужных продуктов (включая нужный продукт) |
|
= |
selectivity |
II. Селективность - отношение между количеством молей с выходом нужного продукта и выходом общего числа ненужных продуктов (не включая нужный продукт).
| nмолей нужного продукта |
| nмолей ненужных продуктов (не включая нужный продукт) |
|
= |
selectivity |
Реакции горения
Полное горение - реакция, в которой продукты сгорания органического вещества в кислороде углекислый газ и вода.
CH4 + 2O2 → CO2 + 2H2O
Частичное сгорание - реакция, в которой продукты сгорания органического вещества в кислороде угарный газ и вода.
CH4 + 3/2O2 → CO + 2H2O
Теоретический кислород (theoretical oxygen)- стехиометрический кислород который нужен для полного сгорания.
Теоретический воздух (theoretical air) - количество воздуха, содержащего кислород в теоретическом количестве. Доля кислорода в воздухе равна 21%. Вычисление избытка кислорода вычисляется по стандартной формуле (nair in - nteoretic air)/nteoretic air = %избытка
Кроме того, в реакциях горения есть как газы на влажном основание (wet base), так и на сухом основание (dry base). Влажное основание - все продукты горения включающие в себя пары воды. Сухое основание все продукты горения, за исключением паров воды.
Пример:
Даны следующие доли молей газ: N2 - 60%, CO2 - 15%, O2 - 10%, остальное вода.
Вычислите молевые доли газа на сухом основание.
Решение: В случае если даны молевые доли веществ, а количество молей нет, то можно взять для решения, 100 молей газа, так как молевые доли не изменяются. Получается - N2 60 молей, CO2 15 молей, O2 10 молей, H2O 15 молей.
Теперь складываем все моли, за исключением воды. Получаем 85 моль газа, которые равны 100%.
N2: 60/85=0.706, CO2: 15/85=0.176, O2: 10/85=0.118
Лит-ра: Felder, R. M. and Rosseau, R. W., "Elementary Principles of Chemical Processes”, 3d Ed., J.Wiley & Sons, New York (1999);
Himmelblau, D. M., "Basic Principles and Calculations in Chemical Engineering”, 6th Ed., Prentice-Hall, New Jersey (1996).
Copyright©C2H5OH,2007
|













