Разработки реакторов №1
Кинетика химической реакции
Химическая реакция определяется как процесс, в котором полностью или частично изменяется молекулярное строение. Атомы внутри молекулы изменяют молекулярное строение по физическим законам и стремятся быть устойчивыми с термодинамической точки зрения.
Химические реакции могут быть как экзотермические, освобождающие энергию, так и эндотермические, поглощающие энергию.
Кинетика химической реакции связана с условиями, в которых находятся реагенты. В кинетике химических реакций измеряется скорость реакции, которая может зависеть от концентрации реагентов, температуры, катализатора и т.д. Скорость химической реакции определяется как определённое количеством реагентов, среагировавших в определённый период времени. Количество выражают в молях.
aA → cC + dD
V = -d[A]/dt
С кинетической точки зрения все реакции проходят в определённом порядке. Рассмотрим три основных положительных порядка химической реакции:
Химическая реакция нулевого порядка, единственная реакция, в которой скорость не зависит от концентрации вещества: r = k .
Химическая реакция первого порядка: r = k*[A]
Химическая реакция первого порядка r = k*[A]m*[B]n = k*[A]2
Псевдореакция первого порядка, реакция, где одно из веществ всегда находится в избытке по сравнению с другим и поэтому можно записать скорость реакции как r = k'*[A] , где k'=k*[B]
Инверсия
Инверсия это соотношение между количеством среагировавших молей вещества относительно начального количества молей вещества. Обозначается иксом. Общая формула инверсии:
x = (Njo - Nj)/Njo
Njo - начальное количество молей вещества А
Nj - конечное количество молей вещества А
Формулы инверсии для разных видов реакций:
Br: x = 1-exp(-k*t)
CSTR: x = k*Θ/(1+k*Θ)
PFR: x = 1-exp(-k*Θ)
На инверсию влияют разные параметры:
Концентрация веществ.
Для того чтобы произошла химическая реакция необходимо столкновение между молекулами или атомами реагентов. Чем выше будет концентрация реагентов, тем выше шанс столкновения. Рассмотрим связь между скоростью реакции и количеством реагента по следующей реакции:
aA + bB → cC + dD
r = -a1-*d[A]/dt = -b1-*d[B]/dt = c1-*d[C]/dt = d1-*d[D]/dt = k*[A]m*[B]n
Из формулы можно увидеть зависимость скорости реакции от концентрации. Минус обозначает исчезновение вещества, а плюс его появление.
Температура.
Любая химическая реакция происходит с поглощением или выделением тепла. Для того чтобы началась реакция, нужно начальное количество энергии, которое называется активирующей энергией Ea. В уравнении скорости химической реакции, постоянная k зависит от температуры:
k = A*exp(-Ea/RT)
Где:
T - температура
R - постоянная газов
A - константа арениуса
Катализатор.
В процессе химической реакции катализатор уменьшает активирующую энергию. Также в процессе его количество не изменяется и остается постоянным.
Реакторы
Реактор это емкость, в которой происходит химическая реакция в промышленных масштабах. При разработке реактора надо учитывать разные параметры, такие как время реакции, объём ёмкости, температура, давление, мощность подачи реагентов, общий коэффициент теплопроводности, концентрация веществ участвующих в реакции и т.д.
реакторы в промышленности делятся на три основных вида:
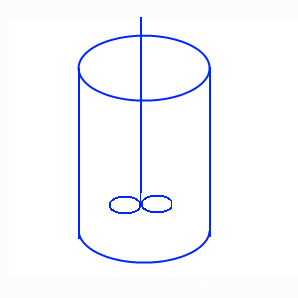
Дольный реактор (Bech Reactor-BR) - работающий в нестойком состоянии, то есть нет входа и выхода веществ, концентрация реагентов и продуктов изменяется со временем происхождения реакции. В таком реакторе есть смеситель для гомогенного распределения реагентов по всему объёму.
Исходя из общей формулы равновесия массы: Fjo - Fj + VRj = dNj/dt
Где:
Fjo - подача вещества
Fj - вывод вещества
VRj - объём реакции
dNj - изменения в системе со временем
j - индекс
убираем подачу и вывод веществ, получаем что VRj = dNj/dt
Инверсия в дольном реакторе определяется как количество среагировавших молей вещества относительно начальному количеству реагировавшего вещества:
xj = (Njo - Nj)/Njo
Далее рассчитываем время реакции исходя из инверсии и концентрации вещества:
-Njodxj/dt = -rV
Cjo = Njo/V
Cjodxj/dt = r
t = Cjo∫dxj/r
Также можно записать реакцию теплообмена для дольного реактора:
ΣNjCpjdT = VΣ(-ΔH)iridt - UA(T-Ts)dt - Wsdt
Где:
(-ΔH) - энергия реакции
Т - температура
Ts - температура стенки реактора
Ws - механическая работа
U - общий коэффициент теплопроводности
А - площадь теплообмена
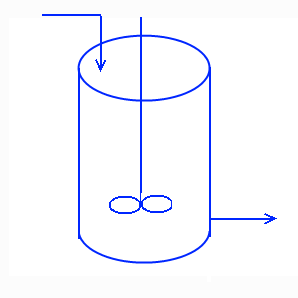
Поточный реактор (Continuous Stirred Tank Reactor-CSTR) - работающий в стойком состоянии (ST.ST.) с помешивание реагентов, то есть в нём существует постоянный вход и выход веществ. В целом в ёмкости нет изменения температуры и концентрации вещества со временем. В таком типе реактора концентрация вещества внутри ёмкости будет равна концентрации вещества при выходе.
Формулы равновесия массы поточного реактора CSTR:
Fjo - Fj + VRj = 0
Исходя из формулы конверсии вещества и постоянной подачи обьема Qo получаем среднестатистическое время реакции Θ:
xj*Fjo - r*V = 0
Cjo = Fjo/Qo
Θ = V/Qo = Cjoxj/r
Реакция теплообмена для CSTR:
ΣFjCpj(T-To) = VΣ(-ΔH)iri - UA(T-Ts) - Ws
Где:
To - температура вещества при входе
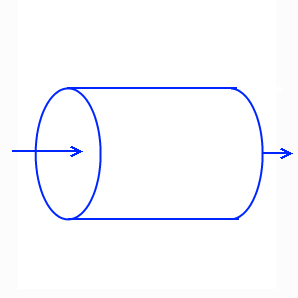
Поточный реактор (Plug Flow Reactor-PFR) - трубкообразный реактор, в котором существует градиент темпа реакции, который изменяется со временем. При входе есть начальная концентрация вещества с определённым темпом реакции, которые по всей длине реактора изменяются и на выходе уменьшаются. В отличие от CSTR, в PFR поставка вещества может происходить по всей длине и поэтому эффективность PFR выше.
В идеальном реакторе PFR происходит турбулентный поток, и концентрация веществ изменяется на протяжении всего объёма реактора.
Формулы равновесия массы поточного реактора PFR:
Fjo - Fj + VRj = 0
Среднестатистическое время получаем как и в реакторе CSTR через инверсию:
Θ = V/Qo = Cjo∫dxj/r
Реакция теплообмена для PFR:
ΣFjCpjdT = Σ(-ΔH)iridV - Ua(T-Ts)dV
Лит-ра: Fogler, H.C. "Elements of Chemical Reaction Engineering”, 3rd Ed., Prentice Hall Int., 1999; Levenspiel O. "Chemical Reaction Engineering", 3rd Ed., John Wiely & sons, NY, 1999; Hill, C.G., "An Introduction to Chemical Engineering Kinetics & Reactor Design", John Wily & sons, NY, 1977.
Copyright©C2H5OH,2010
| 












