Принципы химической технологии №3
Диффузия
Диффузия - процесс переноса вещества с высокой концентрацией в область низкой концентрации.
Молярный поток:
Na,z = -C*Da-mixture*dya/dz + yaΣNi,z
Где:
a - вещество
z - направление потока вещества (a) в растворе
Da-mixture - коэффициент диффузии
C - молярная концентрация
y - молярная доля вещества
N - молярный поток
отсюда диффузионый молярный поток будет: Ja = -Da-mixture*C*dya/dz который надывается закон Фика.
Массовый поток:
Na,z = -ρ*Da-mixture*dya/dz + yaΣNi,z
Где:
ρ - массовая концентрация
Отсюда диффузионный массовый поток будет: Ja = -ρ*Da-mixture*dya/dz
Чтобы рассчитать диффузию надо предположить что газ идеален (PV=nRT).
Диффузия через стагнантное вещество
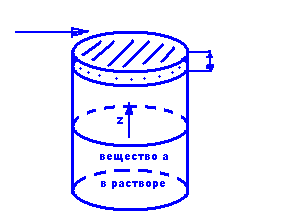
Над сосудом есть давление паров P° определённой жидкости. При потоке газа влево над сосудом происходит диффузия паров жидкости в газ, тем самым газ уносит с собой пары жидкости. Поток газа будет равен нулю, потому что по нашему предположению он находится в "бесконечном" количестве. Это стагнантное вещество (Стагнация - фр. stagnation, от лат. stagno — делаю неподвижным, останавливаю; лат. stagnum — стоячая вода). Отсюда получаем уравнение:
Na,z = ya*Na,z - Da-mixture*C*dya/dz
После решения интеграла с границами z1, z2, ya1 и ya2, получаем окончательную общую формулу:
Na,z = Da-mixture*C*Ln[(1- ya2)/(1-ya1)]*(Z2 - Z1)-1
В случае сосуда Арнольда, молярный поток будет выглядить так:
Na,z = Da-mixture*C*(ya1-ya2)*yLm-1
Где yLm = [(1-ya2)-(1-ya1)]*{ln[(1-ya2)/(1-ya1)]}-1
Когда газ идеален, вместо y можно использовать давление P.
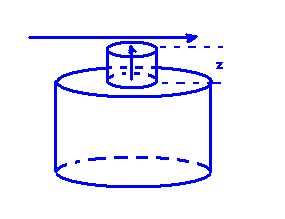 Сосуд Арнольда
Сосуд Арнольда
Диффузия через равномолярную систему
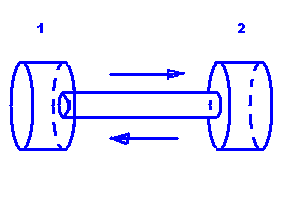
В двух сосудах есть разные соотношения молей двух газов, которые со временем уравниваются. Поскольку массовый поток из первого сосуда во второй равен массовому потоку из второго в первый, то выводим следующее уравнение:
Na,z = ya*(Na,z + Nb,z) -Da-mixture*C*dya/dz
Na,z = -Nb,z → ya*(Na,z + Nb,z) = 0
Na,z = -Da-mixture*C*dya/dz
После решения интеграла с границами z1, z2, ya1 и ya2, получаем окончательную общую формулу:
Na,z = -Da-mixture*C*[(ya2-ya1)/(z2-z1)]
Диффузия в псевдостойком состоянии
Диффузия в псевдостойком состоянии - происходит когда одно вещество находится в стойком состоянии, а другое изменяет свою массу.
Na,z = [Da-mixture*C*(ya1-ya2)]*[(z2-z1)*yLm]-1
Диффузия с химической ракцией
Может происходить в стойком состоянии, но с определённой химической реакцией.
Na + ∂C/∂t - Ra = 0
В нестойком состоянии ∂C/∂t = 0 , соответственно формула будет выглядеть следующим образом: Na - Ra = 0 .
Na = Ra
Na,z = xa*(Na + Nb) - CDa-b*dxa/dza
предположим, что xa << 1 , отсюда Na,z = -CDa-b*dxa/dza
-CDa-b*dxa/dza = Ra (Ra = K1*Ca)
-CDa-b*dxa/dza = K1*Ca
Окончательное решение интеграла:
Ca = C1*cosh[Z*(K1/Da-b)0.5] + C2*sinh[Z*(K1/Da-b)0.5]
Диффузия в нестойком состоянии
Расчет диффузии в нестойком состоянии без химической реакции, Ra=0:
Na = ∂C/∂t
Na,z = - CDa-b*dxa/dza
Второй закон Фика:
уравнение для концентраций: dCa/dt = Da-b*∂2C/∂t2
уравнение для плотностей: dρa/dt = Da-b*∂2C/∂t2
Диффузия в нестойком состоянии происходит в полу бесконечном или в бесконечном медиуме. К полу бесконечным можно отнести сосуд с жидкостью, а в конечном, например, дерево.
Диффузия в полу бесконечном медиуме происходит только в одном направлении и концентрация вещества на поверхности всегда остается постоянной, а с глубиной изменяется. Для вычисления глубины проникания вешества в медиум, надо использовать таблицу стр.26 c формулой (Cas -Cat)/(Cas - Cao) = erf[Z/2*(Da-b*t)0.5] и график стр.24.
Cao - концентрация вещества A в начале.
Cas - концентрация вещества A на поверхности вещества B.
Cat- концентрация вещества A в определённое время.
Глубина проникновения жидкости со временем: δD = 4*(Da-b*t), где t - время проникновения вещества на глубину δD.
δD < L - полубесконечное вещество.
δD > L - конечном вещество.
L может быть как длина или глубина, так и радиус, в зависимости от формы вещества.
Диффузия в конечном медиуме может присходить в двух направлениях, на поверхности медиума концентрация всегда постоянная. Для расчёта диффузии используют графики на стр.38 для поверхности, стр.39 для цилиндра и стр.40 для сферы.
Где:
Y = (Cas-Cat)/(Cas-Cao)
X = (Da-b*t)/X12
n = Da-b/(Kc*X)
m = X/X1
Окончательная формула потока выглядит следующим образом:
Na,z = (4*Da-b)/L * (Cas - Cao) * Σcos[(h*π*Z)/L] * exp{-[(n*π)/2]2 * XD}
Где n=1,3,5,...
Отношение времени, XD = (Da-b*t)/X12
X1 = L/2 - длина проникновения диффузии с двух сторон. Если только с одной, то берем просто L.
Расчет коэффициента диффузии
Расчет коэффициента диффузии в газах производится с помощью уравнения Hirschfelder или Fuller et al. стр.27. или Wilke стр.28. Для расчета этого коэффициента в жидкостях используют Stokes-Einstein, Wilke and chang, Hayduk & Laudie или Nerst стр.28.
Для газов нам необходимо знать σ (сигма), ε (эпсилон) и Ω (омега), которые вычисляются по таблице на стр.29. Для того чтобы рассчитать Ω, в первой таблице по типу вещества надо найти соотношение ε/k, где k в кельвинах, потом единицу разделить на соотношение и умножить на температуру среды, в кельвинах,. Далее по второй таблице находим Ω.
На стр.30 можно также найти диффузионный объём ΣV. Первые две таблицы составлены для газов, вторые две - для жидкостей.
Конвекция вещества
Существуют два вида конвекции вещества, переход вещества в одной фазе и переход вещества между двумя фазами.
Переход вещества в одной фазе - случай когда диффузия вещества А через один слой и сверху есть поток, который сразу же удаляет вещество А.
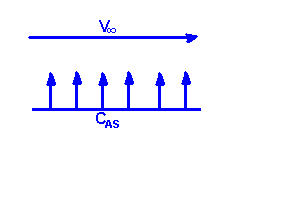
Cas - концентрацией вещества А на поверхности
V∞ - скорость потока
Поток вещества А: Na = Kc*(Cas - Ca∞)
Где:
Kc - коэффициент перехода вещества в конвекции, [длина/время]
Ca - разница между концентрацией на поверхности и среднестатистической концентрации в потоке.
В основном если скорость потока большая, то среднестатистическая концентрация в нем будет стремиться к нулю.
Способы вычисления коэффициента перехода вещества в конвекции, Kc.
Есть разные способы вычисления коэффициента перехода вещества в конвекции, которые описаны на стр.23 и стр.25.
Числа без едениц измерения:
Pr = μ*Cp*k-1 = υ*α-1
Re = ρ*V*d*μ-1 = V*x*υ-1
Sc = υ*Da-b-1 = μ*ρ-1*Da-b-1
Абсобирующая колонна
Абсорбирующая колонна предназначена для разделения веществ, например, очистка одного газа от другого посредством жидкости. Смеси газа проводят ток через жидкость в колонне, которая в свою очередь абсорбирует определённый газ А. Для того, чтобы рассчитать, сколько газа А адсорбировалось, надо знать частичное давление (Pa) этого газа в газовой смеси, (Pi) частичное давление в интерфазе, концентрацию (Ca) газа А в жидкости и концентрацию (Ci) в интерфазе.
Интерфаза представляет собой границу между газовой и жидкой фазой, когда частичное давление и концентрацию в ней измерить приборами невозможно.
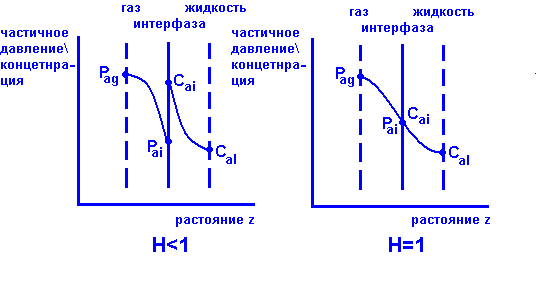
В газовой фазе, где kg - постоянная местного перехода вещества в газе:
Na = kg*(Pa - Pa,i)
В жидкой фазе, где kl - постоянная местного перехода вещества в жидкости:
Na = kl*(Ca,i - Ca)
В расчёт также входит постоянная Генри (вступление в химическую технологию №2) - Pa,i = H*Ca,i. Постоянная Генри зависит от вида вещества и условий среды.
В стойком состоянии Na,g = Na,l. Давление в адсорбирующей колонне равно атмосферному.
Отсюда получаем, что kg*(Pa - Pa,i) = kl*(Ca,i - Ca)
Pa,i = Pa - (kl/kg)*Ca + (kl/kg)*Ca,i
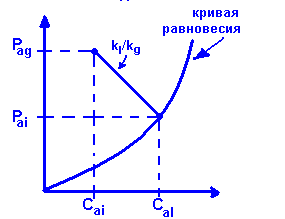
Есть три основных этапа перехода вещества:
1. Диффузия вещества A через газовую фазу.
2. Переход интерфазы.
3. Диффузия вещества A через жидкую фазу.
Pa = H*Ca*
Pa* = H*Ca
Pa,i = H*Ca,i
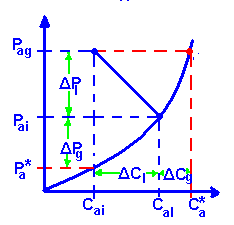
Отсюда получаем потоки с постоянными общего перехода вещества в газе и жидкости:
Na = Kg*(Pa - P*)
Na = Kl*(C* - Ca)
И сопротивления веществ, где m = H при линейной формуле:
Kg-1 = kg-1 + m*(kl-1)
Kl-1 = kl-1 + (m*kg)-1
Общая схема адсорбирующей колонны (Y - доля А в газовой фазе, X - доля А в жидкой фазе):
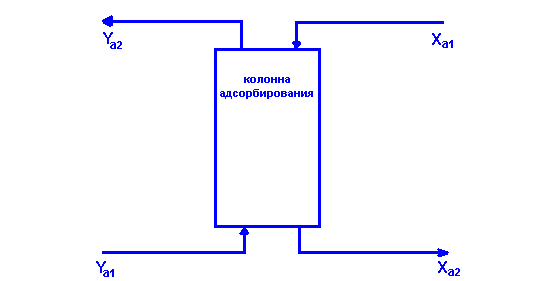
В промышленности есть несколько видов абсорбирующих колонн. Например, ток газа пропускают через жидкость. Такая колонна полудольная, то есть нет постоянного потока жидкости, а есть только поток газа.
Также есть второй вид колонны, где сверху через распылители подается под напором постоянный ток жидкости, а снизу постоянный ток газа. В этом виде колонны есть керамические или другого вида плитки способные увеличить поток вещества.
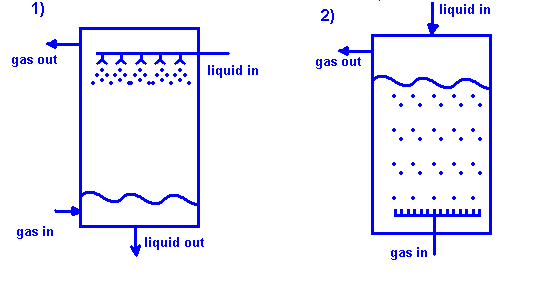
Расчёт противоположной абсорбирующей колонны
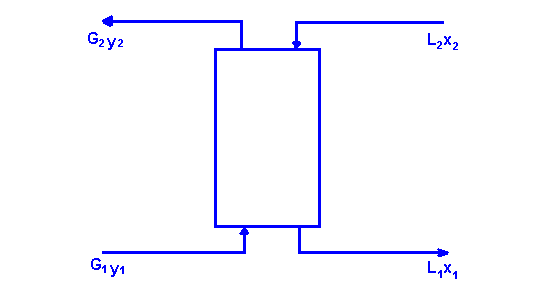
В противоположной абсорбирующей колонне газ всегда поступает снизу, а жидкость сверху. Все потоки снизу обозначаются единицей, а сверху двойкой.
Распишем общее равновесие:
G1*y1 + L2*x2 = G2*y2 + L1*x1
Где: G1 ≠ G2, L1 ≠ L2
Часто для абсорбирующих колонн, уравнения бывают нелинейные, когда процент вещества А больше 1% и поэтому делают нормализацию - делят процент вещества А в потоке на процент потока без вещества А (в отличие от обычного процента, процент после нормализации записываем заглавной буквой):
Ya,1 = ya,1/(1-ya,1)
Тоже самое делаем для общих потоков газа и жидкости, которые будут постоянны на протяжении всей колонны:
Gs = G1*(1-ya,i)
Ls = L2*(1-xa,2)
Отсюда составляем общее равновесие:
Gs*Y1 + Ls*X2 = Gs*Y2 + Ls*X1
Gs*(Y1 - Y2) = Ls*(X1 - X2)
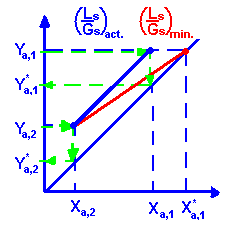
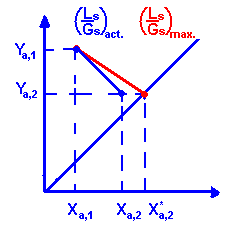
Получаем действующее уравнение, где наклон равен: (Ls/Gs)act. = (Y1 - Y2)/(X1 - X2)
Если провести линию от точек (X2, Y2) до прямой равновесия, получаем минимальное количество жидкости для адсорбции вещества А:
(Ls/Gs)min. = (Y1 - Y2)/(X1* - X2)
Расчёт параллельной абсорбирующей колонны
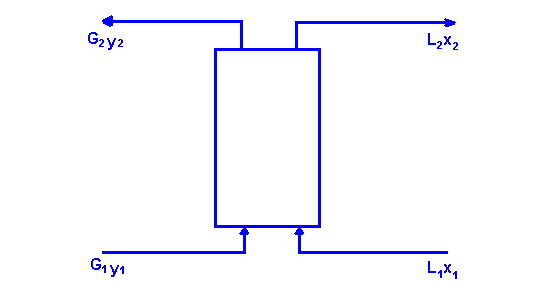
В расчете параллельной абсорбирующей колонны, в отличие от предыдущей перед наклонами ставится знак минуса (-):
- (Ls/Gs)act. = (Y1 - Y2)/(X1 - X2)
- (Ls/Gs)max. = (Y1 - Y2)/(X1 - X2*)
Расчёт высоты абсорбирующей колонны
Высоту абсорбирующей колонны рассчитывают с помощью интеграла -
по газовой фазе:
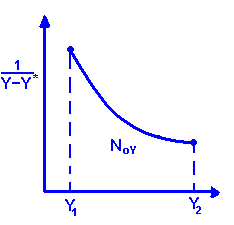
Z = Gs/(Ky*a) * ∫dy/(ya-ya*)
Где:
высота единиц перехода Hoy = Gs/(Ky*a)
число единиц перехода Noy = ∫dy/(ya-ya*)
по жидкой фазе:
Z = Gs/(Kx*a) * ∫dx/(xa*-xa)
Для растворов меньше 10%
Hoy = Gs/(KY*a)
Noy = ∫dY/(Ya-Ya*)
Для нелинейного уравнения равновесия рисуем график и по нему все вычисляем с помощью интеграла.
Для линейного уравнения равновесия есть следующие формулы:
Noy = (Y1-Y2)/ΔYlm
ΔYlm = (ΔY1-ΔY2)/ln{ΔY1/ΔY2)
ΔY = Y - Y*
Противоположный поток, где процент вещества А равен нулю, рассчитавается по формуле на стр.31, где α = (Ls/Gs)/m - коэффициент впитывания.
В случае когда α = 1, то действующее уравнение будет
Noy = (Y1-Y2)/(Y2-Y2*)
Ли-ра: Welty, J.R., Wicks, C.F.,Wilson, R.E., Rorrer G., "Fundamentals of Momentum, Heat, and Mass Transfer”, 4th Ed., John Wiley & Sons, New York, (2001); McCabe, W.L., Smith, J.C., Harriott, P., "Unit Operations of Chemical Engineering”, 6th Ed., McGraw Hill, New York, (2001); Coulson, J.M., Richardson, J.F., "Chemical Engineering”, Vol. 2, 4th Ed., Butterworth-Heinemann, Oxford, (1991); Bird, R. B., Stewart, W. E., Lightfoot, E. N., "Transport Phenomena”, 2nd Ed., John Wiley & Sons, New York, (2002).
Copyright©C2H5OH,2009
|













