Основные работы в химической технологии
В химической технологии помимо разнообразия химических реакций есть множество физических способов очистки требуемого вещества. В этом разделе опишем три основных:
1.Дистилляция - разделение двух или более веществ с разными точками кипения. Очистка основывается на равновесие "газ-жидкость".
2.Экстракция - - способ очистки, который основывается на равновесии "жидкость – жидкость”. Принцип действия: переход вещества из одной жидкости в другую, когда растворимость обоих жидкостей друг в друге низкая.
3.Фильтрование - отделение взвешенного вещества от водного раствора.
Дистилляция
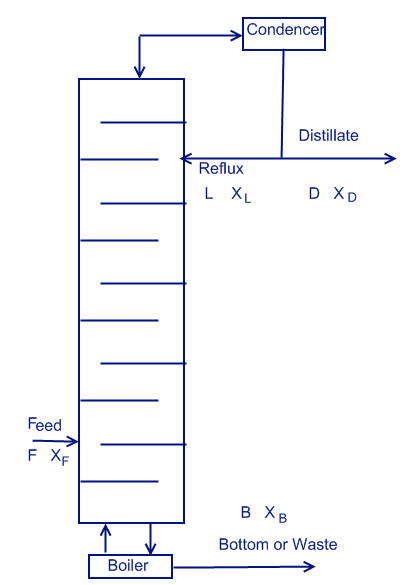
Один из наиболее распространённых процессов в нефтепромышленности. Этот процесс производится в колонне высотой от 3 до 75 метров и диаметром от 0,3 до 10 метров. Есть два вида колонн - с возвратом (Reflux) и без No Reflux. также колонны могут быть в дольном процессе или постоянном.
Колонна состоит из множества тарелок по всей длине, в нижней части находится бойлер, нагревающий смесь, а в верхней холодильник, охлаждающий пары. Продукт дистилляции называется дистиллятом.
Диаграмма температуры кипения
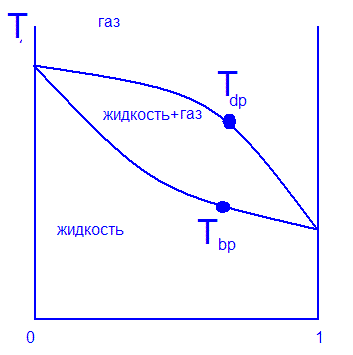
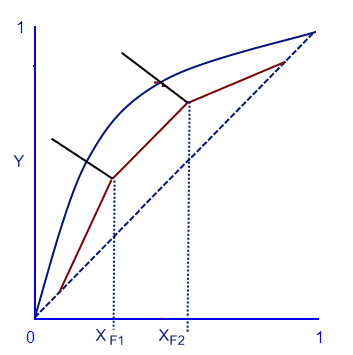
Диаграмма точки кипения показывает нам бинарный раствор, в котором изменяется температура при постоянном давлении. Из этой диаграммы можно найти точку первого пузыря и первой капли росы по определенной концентрации веществ.
Диаграмма равновесия
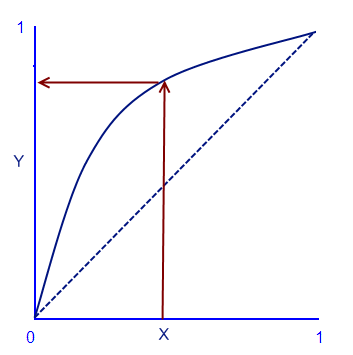
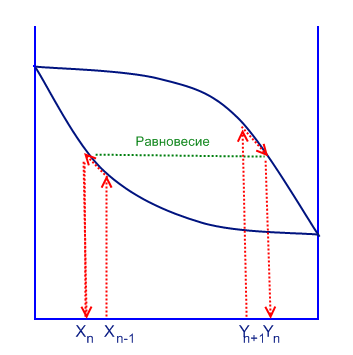
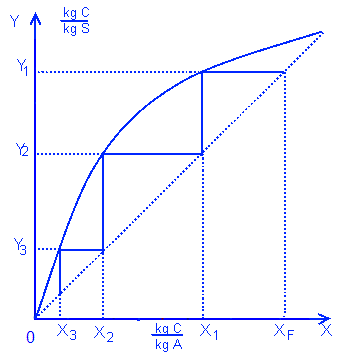
С помощью этой диаграммы можно вычислить молярный процент летучего вещества в газовой фазе, когда дан молярный процент летучего вещества в жидкой фазе. И наоборот. Для этого надо провести прямую линию от данного процента до кривой равновесия и найти соответствующую точку (выделено красной линией). В случае азеотропа, кривая равновесия будет выглядеть иначе.
Также можно вычислить точки с помощью закона Рауля-Дальтона для идеальных растворов (введение в хим.тех.№2):
XiP°i = YiPt
Xi - доля вещества в жидкой фазе
Yi - доля вещества в газовой фазе
P°i - давление паров
Pt - общее давление
X1 + X2 = 1
Y1 + Y2 = 1
Относительная летучесть вещества, это соотношение между процентами в газовой фазе к процентам в жидкой фазе. Обозначается как αi = yi/xi = Ki. Чем больше это число, тем вещество более летучее. Если α=1, значит невозможно отделить вещества с помощью перегонки.
Дольная дистилляция
В дольной дистилляции существует всего один этап перегонки бинарного раствора. Обычно такой дистилляцией пользуются в лабораториях и не всегда возможно достичь высокого процента очистки.
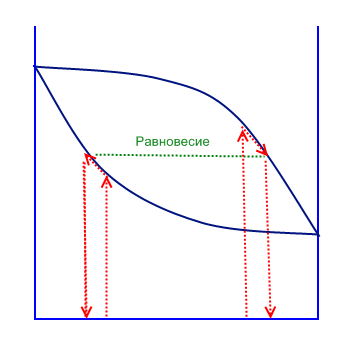 Дольная - дифференциальная дистилляция
Дольная - дифференциальная дистилляция
В такой дистилляции используют интеграл, который обозначает площадь под кривой на графике.
Ln(S/So) = ∫dxA/(yA - xA)
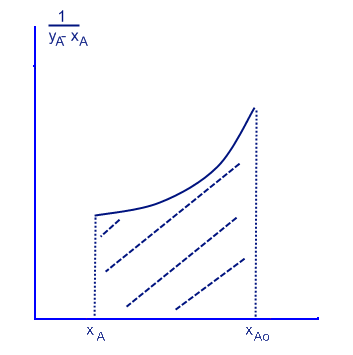
Можно также решить с помощью заранее данной функции y=n*x+m
Или с помощью относительной летучести: α
yA = αAB*XA/[1 + (αAB-1)*XA]
Ln(S/So) = 1/(αAB-1)*Ln[XA*(1-XAo)/XAo*(1-XA)] + Ln[(1-XAo)/(1-XA)]
Дистилляционная колонна
Дистилляционной колонной пользуются очень часто в нефтеперерабатывающей промышленности, с помощью которой можно достичь процента желаемой очистки. Причем это постоянный процесс дистилляции, а не дольный.
По сути дела это большая труба, внутри которой есть множество тарелок. Каждая тарелка представляет собой единичную кривую равновесия. В колонне есть вход для подачи смеси, есть верхний выход для дистиллята, и нижний выход для остатков.
В верхнем выходе дистиллят попадает в охладитель и конденсируется. Помимо того есть возврат (Рифлакс), который способствует увеличению качества очистки.
В нижней части есть бойлер. Он предназначен для нагрева раствора.
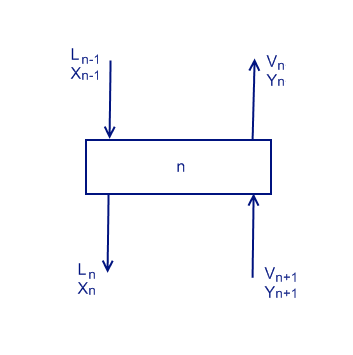
Тарелки равновесия, диски, с отверстиями на которых конденсируется или нагревается часть вещества. Число тарелок обозначается буквой N.
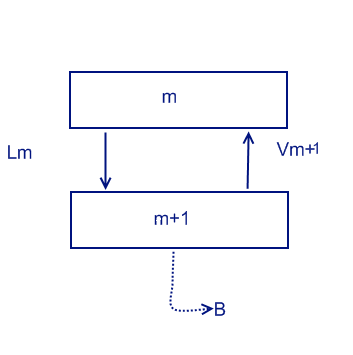
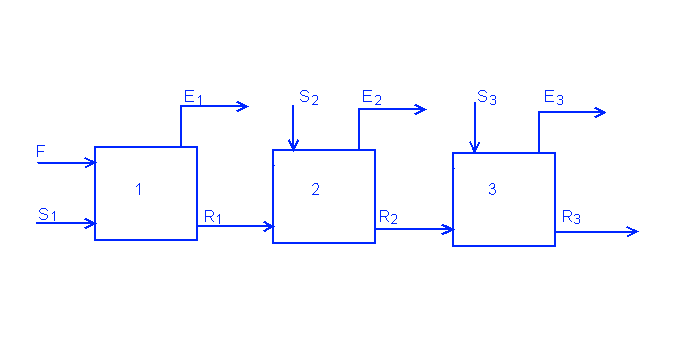
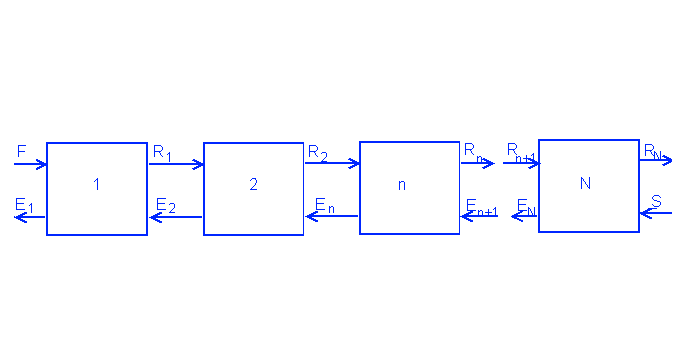
Рассмотрим схему на начальной тарелке (на которой осуществляется подача раствора). Необязательно чтобы подача была в самом конце колонны. Обозначим ее как число n. L обозначает подачу сконденсировавшейся жидкости, V обозначает нагретые пары.
Можно показать данный процесс в виде графика:
Формула баланса:
Общего на всю колонну:
F = B + D
Определённого компонента на всю колонну:
F*XF = B*XB + D*XD
На верхнюю часть колонны (выше подачи):
Vn+1 = Ln + D
Vn+1*yn+1 = Ln*xn + D*xD
Рабочая верхняя линия: yn+1 = Ln/(Ln+D) * xn + D*xD/(Ln+D)
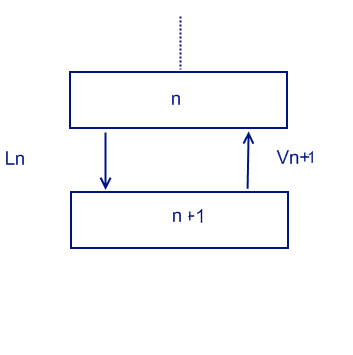
На нижнюю часть колонны (ниже подачи):
Lm = Vm+1 + B
Lm*xm = Vm+1*ym+1 + B*xB
Нижняя рабочая линяя ym+1 = Lm/(Lm-B) * xm - B*xD/(Lm-B)
 Метод McCable-Thile
Метод McCable-Thile
Метод McCable-Thile используется для разработки дистилляционной колонны. В расчет берут несколько точек: адиабатную систему, а также энтальпия выпаривания и конденсирования равны. Поток жидкости и пара в верхней части колоны на каждой тарелке равен. В нижней же части колонны потоки не равны.
Для того чтобы построить диаграмму равновесия при постоянном давлении, нужно знать точку питания системы F (выделена чёрным цветом), потом приравниваем к нулю xn из формулы рабочей верхней линии и получим точку пересечения yn+1 = D*xD/(Ln+D) = xD/(1+RD). От точки xD проведем красную верхнюю рабочую линию вниз до xD/(1+RD). Далее от нижней зелёной точки xВ проводим зеленую рабочую линию вверх до пересечения красной и черной линии.
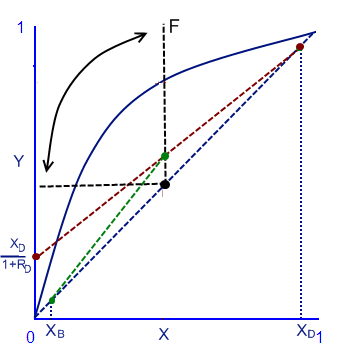
Чёрная линия питания F может быть под наклоном от 0 до 90 градусов. Всё зависит от того, что подается при питании. Обозначим черную линию буквой q. Если подача состоит только из насыщенной жидкости, то линия F будет под наклоном в 90 градусов, q=1, если насыщенный пар то будет наклон в 0 градусов, q=0. Если это смесь жидкости и газа, то надо знать начальный состав и исходя из соотношений вычислить наклон линии q по следующей формуле: yq = -q/(1-q)*xq + xF/(1-q).
В случае подачи перегретого пара, q будет под наклоном ниже 0 градусов, а если переохлажденная жидкость, то наклон q будет больше 90 градусов.
После построения диаграммы можно приступать к вычислению тарелок, которые будут находиться в колонне. Начинаем спускаться по ступеням от верхней точки xD к нижней точкой xВ. Потом от найденного количества ступеней отнимаем единицу и получаем количество тарелок в колонне, поскольку бойлер не считается тарелкой.
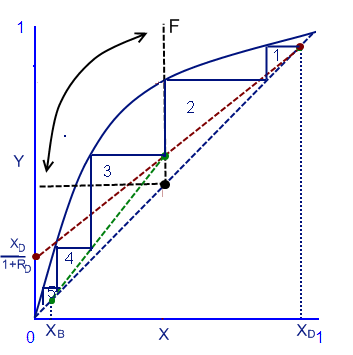
На рисунке видно всего 4 полные ступени и одна неполная, так как она пересекает точку xВ. Однако можно сказать, что мы получили 5 ступеней и, отняв 1, получаем четыре тарелки в колонне данного случая.
Значение RD
RD это поток частичного возврата в колонну. Чем выше значение RD тем меньше нужно тарелок в колонне. Если RD стремится к бесконечности, то получается что нет продуктов дистилляции.
Метод Lewis-Sorel
Метод Lewis-Sorel применяется, когда даны нам данные о системе: xD, xB, q, RD. Мы знаем что y1 = xD и тогда подставляем y1 в формулу равновесия, находим x1. x1 поставляем в формулу рабочей линии и находим y2. y2 подставляем в формулу равновесия, находим x2 и т.д и т.п.
Когда подходим к составу потока F заменяем формулу рабочей линии на нижнюю. По окончанию найденный x должен быть равен xB быть или меньше его. Число подстановок в формулу равновесия равно числу ступеней на графике.
Система с несколькими подачами и выходами
Существуют колонны с несколькими подачами и выходами. Такие системы очень распространены в нефтеперерабатывающей промышленности.
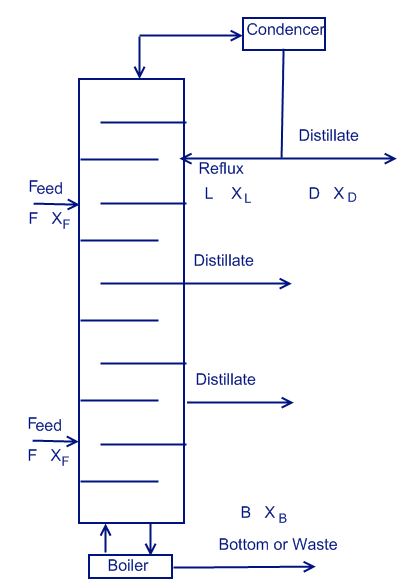
В отличие от систем с одной подачей, где существует только две рабочих линии, в этих системах может быть несколько рабочих линий.
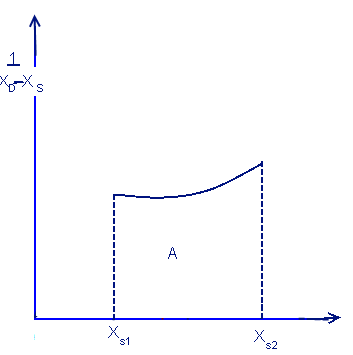
 Дольная многоступенчатая дистилляция
Дольная многоступенчатая дистилляция
У дольной многоступенчатой дистилляции нету постоянного потока и существуют два положения:
1) Сохраняя соотношение между возвратом и дистиллятом постоянное (RD = const.), то состав дистиллята (XD) изменяется со временем.
2) Сохраняя состав дистиллята постоянным (XD = const.), соотношение между возвратом и дистиллятом будет увеличиваться со временем.
Соотношение между возвратом и дистиллятом постоянное (RD = const.):
Рассчитаем общее соотношение масс, где моли в колонне равны молям в дистилляте: -dS = dD
Соотношения масс на летучее вещество: XDdD = -(S*Xs)
-XD*dS = -SdXs - XsdS
∫dS/S = ∫dXs/(XD-Xs)
Ln[S2/S1] = ∫dXs/(XD-Xs)
Для того чтобы решить интеграл необходимы данные опыта и построение графика данных:
Состав дистиллята постоянный (XD = const.):
Составим равновесия масс: S1 - S2 = D
S1*XS1 - S1*XS2 = D*X1*XD
D = S1[(*XS1 - *XS2)/(*XD - *XS2)]
Экстракция
Экстракция - это способ очистки, который основывается на равновесии ”жидкость – жидкость”. Принцип действия: переход вещества из одной жидкости в другую, когда растворимость обеих жидкостей друг в друге низкая или полностью отсутствует.
Используют экстракции в том случае, когда дистилляцией невозможно разделить два компонента.
В этом процессе существуют два вида графиков бинарный и тринарный. Бинарный используют в случае полного отсутствия растворения одного раствора в другом, а тринарный, когда один растворитель частично растворяется в другом.
В конце экстракции получают две разделённые фазы: экстракт (Е) и рафинад (R). В экстракте всегда получаем больший процент нужного вещества, чем в рафинаде.
Рассмотрим виды постоянной экстракции:
Частичная растворимость двух растворителей друг в друге в параллельном потоке.
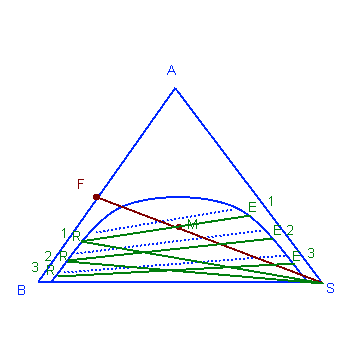
В первом типе экстракции используют тринарный график, где сначала обозначают точку питания F и соединяют ее линией с точкой S. Также находят точку М через баланс вещества. Потом с помощью вспомогательных линий (синими точками) проводим зелёную линию через точку М и находим проценты экстракта и рафинада первого этапа. Далее от рафинада первого этапа проводим зеленую линию до точки S, находим новую точку М и с помощью вспомогательных линий находим проценты экстракта и рафинада второго этапа. Так продолжаем пока не доходим до нужного количества вещества в экстракте или рафинаде:
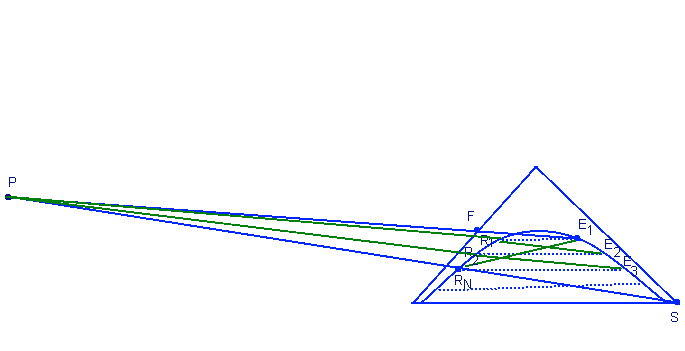
Частичная растворимость двух растворителей друг в друге в противоположном потоке:
Противоположная экстракция намного эффективнее параллельной. По тринарному графику находим точки F, S, а также мы должны знать RN. Через общую точку Р соединяем каждый раз рафинад с новым экстрактом пока через вспомогательные линии не доходим до самой точки RN.
Отсутствие растворимости двух растворителей друг в друге в параллельном потоке:
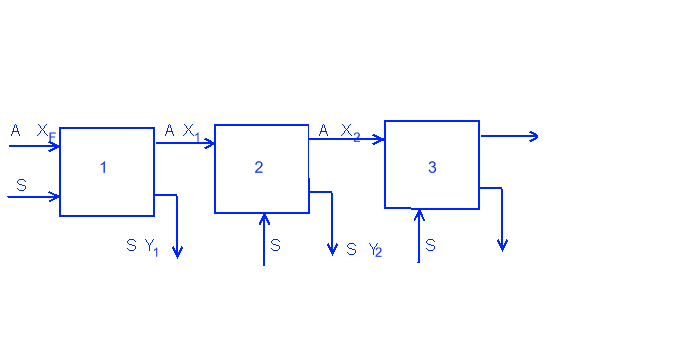
С - растворимое вещество
А - водный растворитель
S - органический растворитель
При полном отсутствии растворимости двух растворителей одного в другом находим массовые доли растворённого вещества (заглавные буквы X и Y):
X=x/(1-x)
Y=y/(1-y)
После чего с помощью уравнения рабочей линии A*XF = A*X1 + S*Y1 и данного уравнения кривой равновесия (предположим что равновесие идет по прямой Y=m*X), находим точки X1 и Y1. Далее вместо XF в уравнение рабочей лини записываем X1, вместо X1 и Y1 записываем X2 и Y2 : A*X1 = A*X2 + S*Y2 и т. д. пока не доходим до нужной концентрации растворимого вещества в рафинаде.
По количеству рабочих линий определяют количество стадий экстракции.
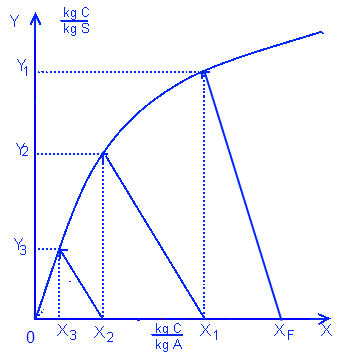
Отсутствие растворимости двух растворителей друг в друге в противоположном потоке:
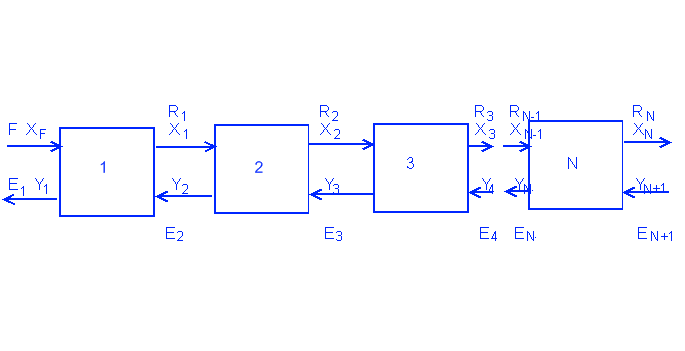
Противоположная экстракция всегда более эффективна, чем параллельная. В этом случае график работы похож на график дистилляции, где количество стадий находят по количеству ступеней.
Уравнение первой стадии: A*XF + S*Y2 = A*X1 + S*Y1
Уравнение N стадии: A*XN-1 + S*YN+1 = A*XN + S*YN
Уравнение от первой до N стадии: A*XF + S*YN+1 = A*XN + S*Y1
Фильтрование
Фильтрование - удаление взвешенного вещества из водной массы путем прохождения через слой пористого материала. В простой фильтрации пермеат — фильтрат, ретенат — твёрдая, отделяемая фаза. Фильтрование производят либо при постоянном давлении, либо при постоянном потоке жидкости.
При постоянном давлении поток жидкости будет уменьшаться на протяжении фильтрации. При постоянном потоке давление будет увеличиваться на протяжении процесса.
Рассмотрим схему разницы в давлениях на фильтрующей мембране:
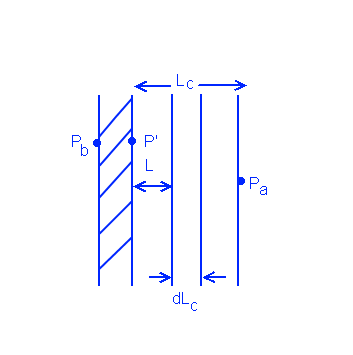
ΔP = Pa - Pb = (Pa - P') + (P' - Pb) = ΔPc - ΔPm
Где:
Pa - давление на поверхности ретената
P' - давление между ретенатом и фильтром
Pb - давление со стороны пермеата
ΔPc - разница в давлении ретената
ΔPm - разница в давлении фильтра
Формула описывающая разницу в давлении (способ Kozeny-Carmen):
dP/dL = (150*μ*U*(1-ε)2)/((Фs*Dp)2*ε3)
Где:
μ - вязкость суспензии
U - скорость суспензии
Фs - шарообразность частицы (бывает от 0 до 1) Фs = Vp/Dp*Sp
Dp - диаметр частицы
Vp - объём частицы
Sp - лицевая площадь частицы
Объём твердых веществ: dV = (1-ε)*A*dL
Масса ретената: dm = ρp*(1-ε)*A*dL
Отсюда следует, что: dP = (150*μ*U*(1-ε)*(Sp/Vp)2)/(ρp*A*ε3*gc)*dm
Упругость ретената
Упругость ретената существует когда разница в давлениях не высокая, частицы одинаковы и механически устойчивы. Обозначают упругость α.
α = (150*(1-ε)) / ((Фs*Dp)2*ε3*ρp)
Упругость фильтра
Упругость фильтра может изменяться в зависимости от разницы давления, но его можно выражать как и постоянное число.
Rm = ΔPm/μ*U
Значение упругости фильтра бывает только в самом начале фильтрования, когда ретенат еще не появился или имеет очень маленький слой на поверхности фильтра. Со временем ретенат увеличивается, а упругость уменьшается.
Отсюда можно выразить разницу в давлении:
ΔP = ΔPc - ΔPm = μ*U*(mc*α/A + Rm)
Массу ретената выражают через следующее уравнение:
mc = C*V , где C = Cf/(1-mf/mc-1)*Cf/ρ
Где:
Cf - концентрация фильтрата
mf - масса влажного ретената
mc - масса сухого ретената
ρ - плотность фильтрата
Фильтрование при постоянном давлении
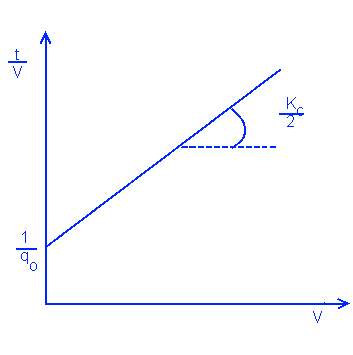
При постоянном давлении поток изменяется со временем. Общую формулу выражают так:
dt/dV = Kc*V/2 + 1/qo
Где Kc = μ*С*α/A2*ΔP
qo - скорость начального потока
Поскольку это линейное уравнение то можно через него выразить следующий график:
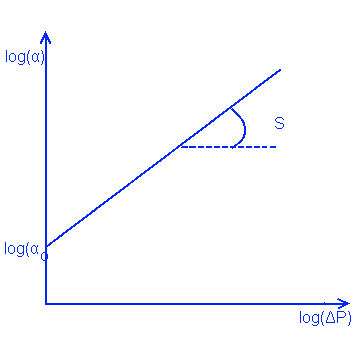
В ретенате который поддаётся сжатию, α изменяется с давлением: α = αo*(ΔPc)s
S коэффициент сжатия который вычисляют опытным путем:
log(α) = log(αo) + S*log(ΔPc)
уравнение линейное и можно построить его график:
Фильтрование при постоянном потоке
При постоянном потоке ΔP изменяется со временем:
ΔP/α = μ*С/t * (V/A)2
Лит-ра: McCabe, W.L., Smith, J.C., Harriott, P., "Unit Operations of Chemical Engineering”, 6th Ed., McGraw Hill, New York, (2001); Coulson, J.M., Richardson, J.F., "Chemical Engineering”, Vo1. 2, 4th Ed., Pergamon Press, New York, (1991).
Copyright©C2H5OH,2010
| 












