Причислить синтез конкретного соединения к событиям, именуемым важнейшими открытиями, можно только в том случае, когда такой синтез представляет собой заметное явление в химии. Получение холестерина, кортизона и стрихнина связано с именем американского ученого Роберта Бернса Вудворда (1917–1979), выдающегося химика-органика ХХ столетия. Работы этого ученого представляют собой череду выдающихся событий. Приступая к синтезу холестерина и кортизона, Вудворд уже имел за плечами крупное достижение – полный синтез хинина (антималярийное средство), соединения из группы алкалоидов.
Вполне естественно, что перед тем, как начинать синтез соединения, необходимо знать его строение. А потому вначале нам следует рассказать о том, чьи именно работы открыли путь для творчества Вудворда, а также пояснить, чем интересны именно эти соединения.
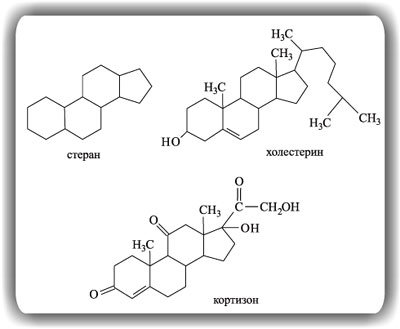
Холестерин содержится почти во всех клетках живого организма (особенно в почках и кожном сале), он регулирует процессы диффузии различных веществ через стенки клеток, а также служит источником для синтеза в организме других важных соединений, в том числе и кортизона. Холестерин поступает в организм вместе с пищевыми продуктами (яичный желток, молоко), но также может в необходимых количествах синтезироваться в организме из небольших органических молекул. Избыточное содержание холестерина в организме часто приводит к атеросклерозу. Кроме того, камни, образующиеся в желчном пузыре и желчных путях, состоят в основном из холестерина. Строение холестерина было установлено немецкими химиками-органиками А.Виндаусом и Г.Виландом, которые подвергали природный холестерин, полученный из кожного жира ланолина, различным реакциям (окислению, дегидрированию) и затем анализировали продукты расщепления. Полученные доказательства строения многим химикам казались неубедительными, поэтому полный синтез холестерина, предпринятый Вудвордом, должен был попутно внести окончательную ясность в этот вопрос.
Кортизон представляет собой гормон, который вырабатывается в коре надпочечников животных и человека. Кортизон регулирует обмен белков, жиров и углеводов в организме. Интерес к кортизону вполне оправдан, поскольку он служит универсальным средством от широкого спектра аллергических заболеваний, ревматоидного артрита, бронхиальной астмы и некоторых других патологий. За исследование строения и биологического действия кортизона, а также других соединений этого класса американские ученые Э.Кендалл и Ф.Хенч совместно со швейцарским ученым Т.Рейхштейном были удостоены в 1950 г. Нобелевской премии по физиологии и медицине.
Холестерин и кортизон относятся к группе органических соединений, называемых стероидами. Отличительный признак стероидов – наличие в их молекулах фрагмента из конденсированных (как бы спаянных вместе) трех шестичленных и одного пятичленного цикла. Этот фрагмент называют стераном. Холестерин и кортизон представляют собой производные стерана, содержащие различные заместители и двойные связи.
Все приведенные далее многостадийные синтезы были продуманы и спланированы Вудвордом от начала до конца, прежде чем он начал эксперименты. Для осуществления намеченных планов Вудворду не пришлось открывать новые типы реакций или неизвестные ранее превращения. Практически все взаимодействия реагентов на каждой стадии были хорошо известны и входили в арсенал химиков-синтетиков. Большинство использованных им реакций буквально описано в учебниках. Можно сказать, что из обычного строительного кирпича Вудворд создавал эстетически совершенные архитектурные сооружения.
Особое изящество решения Вудворда состояло в том, что холестерин и кортизон он начал синтезировать одним и тем же путем, но на определенном участке схемы пути разошлись, что в конечном итоге привело к двум намеченным соединениям. Разберем обе схемы в упрощенном варианте, пропуская некоторые стадии перегруппировки и изомеризации. Для того чтобы было легче проследить за сборкой этих сложных молекул, мы будем отмечать каждый шестичленный циклический фрагмент условным значком, помещенным внутри цикла: *, @, # и &.
Синтез холестерина
В качестве исходного соединения Вудворд взял замещенный бензохинон А и провел его конденсацию с бутадиеном Б. В полученном соединении В с помощью алюмогидрида лития он восстановил группы С=О хинона до спиртовых групп С–ОН (продукт реакции – диол Г).
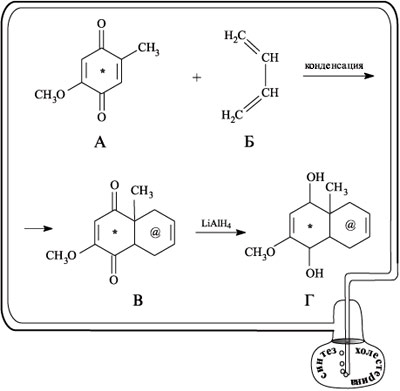
Щелочным гидролизом в диоле Г была удалена метоксигруппа, а последующей перегруппировкой при дегидратации получен непредельный оксикетон Д. При действии на вещество Д цинком в уксусной кислоте группа ОН восстанавливается и получается соединение Е. При взаимодействии Е с этиловым эфиром муравьиной кислоты в присутствии металлического натрия происходит присоединение гидроксиметиленовой группы СНОН с образованием вещества Ж. При действии на Ж этилвинилкетоном образуется дикетон З – соединение с двумя группами С=О.
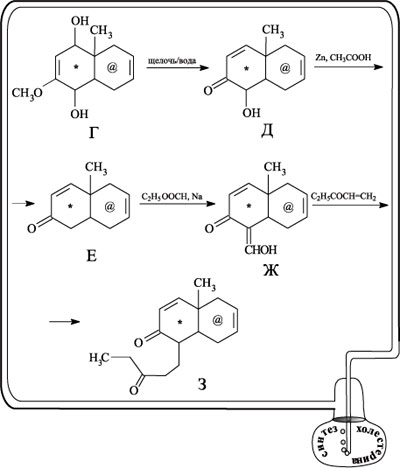
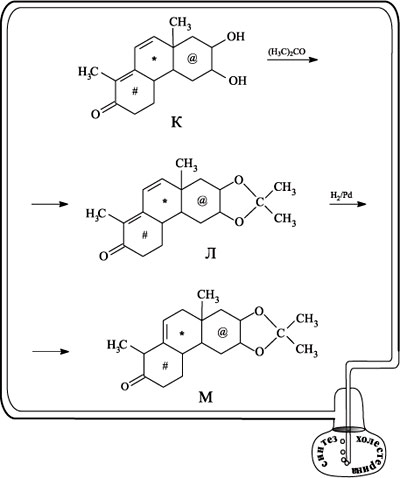
Из схемы реакции видно, что соединение З представляет собой заготовку для получения соединения, содержащего три конденсированных шестичленных цикла. Замыкание третьего цикла происходит в результате внутримолекулярной конденсации вещества З в трициклический кетон И. При последующем действии на кетон И тетраоксидом осмия в молекулу по двойной связи вводятся две группы ОН, получается дигидроксикетон К. Две другие двойные связи при окислении не затрагиваются, поскольку, как точно рассчитал Вудворд, они экранированы метильными группами.
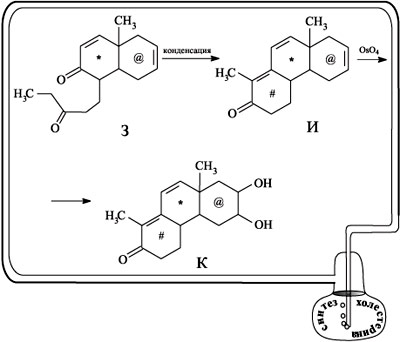
При конденсации с ацетоном две ОН-группы дигидроксикетона К образуют пятичленный цикл – в результате образуется соединение Л. Следующая стадия – гидрирование на палладиевом катализаторе – направлена на восстановление одной из двойных связей (в шестичленном цикле, содержащем кетонную группу), вторая двойная связь (в цикле *) при этом перемещается, и получается вещество М.
Следующий шаг – повторение той стадии, которая превратила соединение Е в соединение Ж (см. несколько выше), т.е. введение гидроксиметиленовой группы СНОН и синтез вещества Н. Группу СНОН защищают от реагента (акрилонитрила) на следующей стадии реакцией с метиланилином, при этом образуется вещество О.
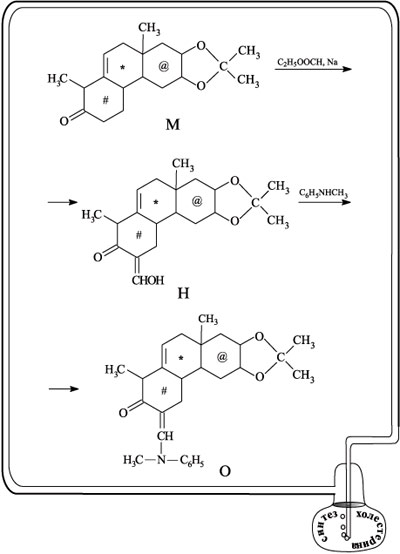
Следующий, участвующий в процессе реагент – акрилонитрил СН2=СН–С N – присоединяется к углероду цикла, несущему метильную группу, соседствующую с карбонильной (продукт реакции П). На следующей стадии фрагмент, содержащий аминную группу, отсоединяется, а нитрильная группа омыляется до карбоксильной (соединение Р). При действии на Р уксусным ангидридом образуется новый шестичленный цикл, отмеченный значком & (соединение С).
N – присоединяется к углероду цикла, несущему метильную группу, соседствующую с карбонильной (продукт реакции П). На следующей стадии фрагмент, содержащий аминную группу, отсоединяется, а нитрильная группа омыляется до карбоксильной (соединение Р). При действии на Р уксусным ангидридом образуется новый шестичленный цикл, отмеченный значком & (соединение С).
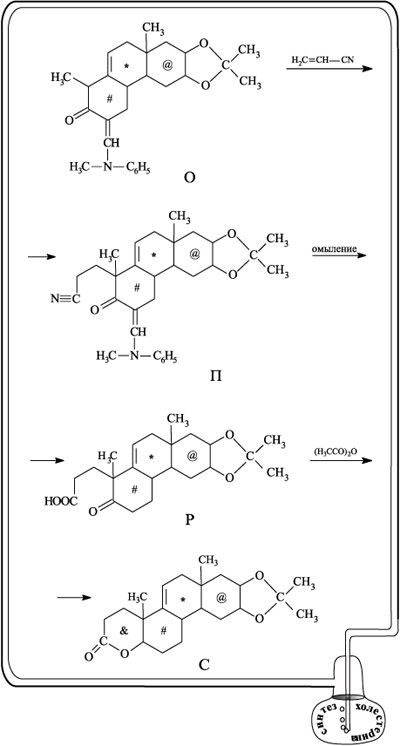
Интересно, что на следующей стадии только что образованный цикл вновь размыкают (действием на С реактивом Гриньяра H3CMgI) и получают дикетон Т. В результате внутримолекулярной конденсации вещества Т цикл образуется вновь, но он уже не содержит атома кислорода (сравните строение С и У). Именно в этом назначение двух последних стадий.
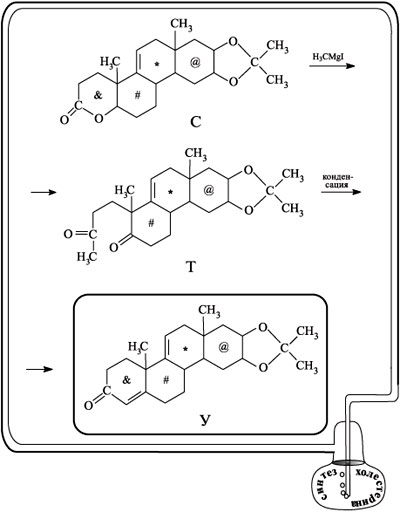
Соединение У стало той точкой разветвления пути, о которой мы упоминали ранее. С этого соединения началось второе направление синтеза, которое привело к кортизону. Речь о кортизоне пойдет несколько позже, пока же проследим за получением холестерина.
Начиная с вещества У, внимание Вудворда переключается на правую часть молекулы У, а конкретно – на пятичленный циклический фрагмент. При действии на У окислителем – йодной кислотой – шестичленный цикл, обозначенный значком @, исчезает и образуется диальдегид Ф. После внутримолекулярной конденсации из него образуется пятичленное кольцо на том месте, где был шестичленный цикл @ (вещество Х). Альдегидную группу, присоединенную к этому кольцу, окисляют до карбоксильной группы (соединение Ц) и этерифицируют. В итоге образуется соединение И, содержащее сложноэфирную группу СООСН3. После гидрирования соединения Ч все двойные связи, расположенные внутри циклов, исчезают (соединение Ш). В полученном соединении кетонную группу (слева внизу) переводят в ацетатную, а сложноэфирную (справа вверху) – в хлорангидридную (вещество Щ). В хлорангидридной группе действием диметилкадмия хлор заменяют на метильную группу. В итоге получают соединение Э с ацетильной группой С(О)СН3.
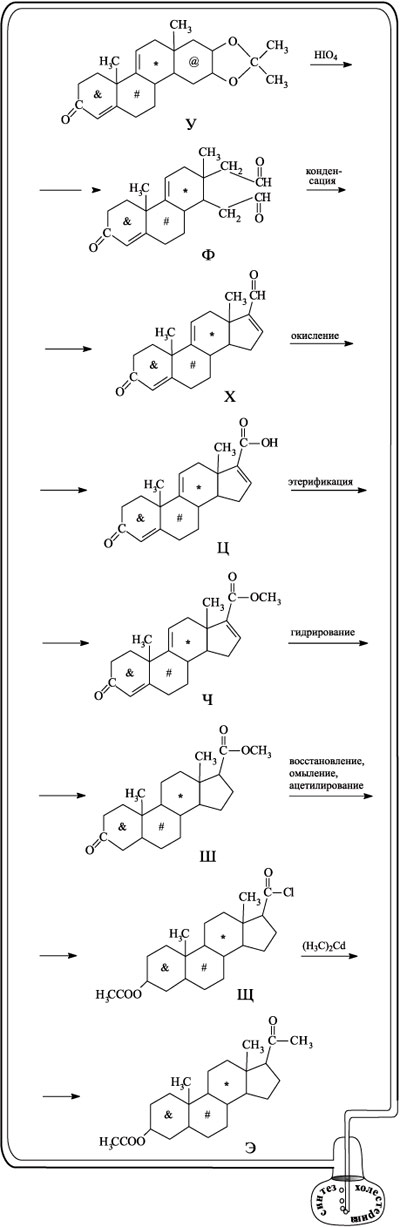
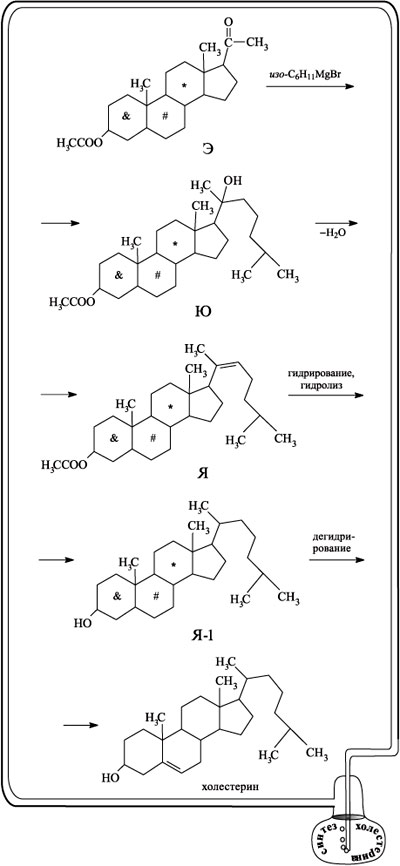
Начиная с этого момента, можно сказать, что синтез вышел на финишную прямую. Введенная ацетильная группа служит точкой, к которой присоединяют длинную, заранее заготовленную углеводородную цепь, содержащую ветвление (в полном соответствии со строением целевого соединения). Присоединение осуществляют с помощью реактива Гриньяра и получают соединение Ю. Дегидратацией соединения Ю получают вещество Я с двойной связью. Двойную связь в боковой цепи гидрируют, а находящуюся слева внизу ацетоксигруппу путем гидролиза переводят в группу ОН (соединение Я-1). Последующее дегидрирование, проходящее в цикле со значком #, приводит к холестерину.
Синтез кортизона
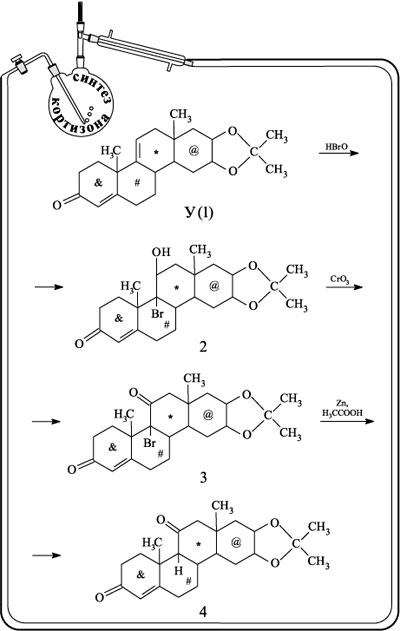
Получение кортизона было начато с пентациклического соединения, синтезированного на одном из промежуточных этапов при создании холестерина (см. выше соединение У). В схеме, показанной далее, это соединение обозначено У(1). Присоединение бромноватистой кислоты HBrO к двойной связи в цикле, отмеченном значком *, приводит к бромпроизводному 2 (в схеме получения кортизона все промежуточные соединения отмечены не буквами, а цифрами). Его окисление хромовым ангидридом CrO3 превращает гидроксигруппу ОН в кетонную С=О (соединение 3). Действием цинка в уксусной кислоте атом брома замещают на атом водорода (вещество 4).
Последующие две стадии полностью воспроизводят описанные ранее в схеме получения холестерина превращения У в Ф и Ф в Х. В результате исчезает цикл, отмеченный значком @, и образуется пятичленный углеводородный цикл с альдегидной группой.
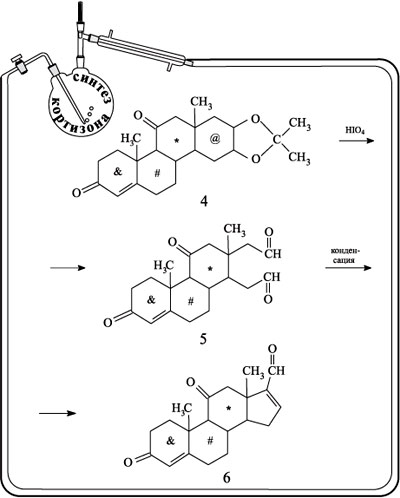
Соединение 6 окислили пероксидом водорода по двойной связи пятичленного цикла. В результате получили оксид 7. При обработке соединения оксидом серебра в щелочной среде альдегидная группа превращается в карбоксильную (продукт реакции – соль 8). Взаимодействие соли 8 с диазометаном CH2N2 дает диазокетон 9. Кипячение вещества 9 с уксусной кислотой превращает диазофрагмент молекулы в ацетатную группу (соединение 10).
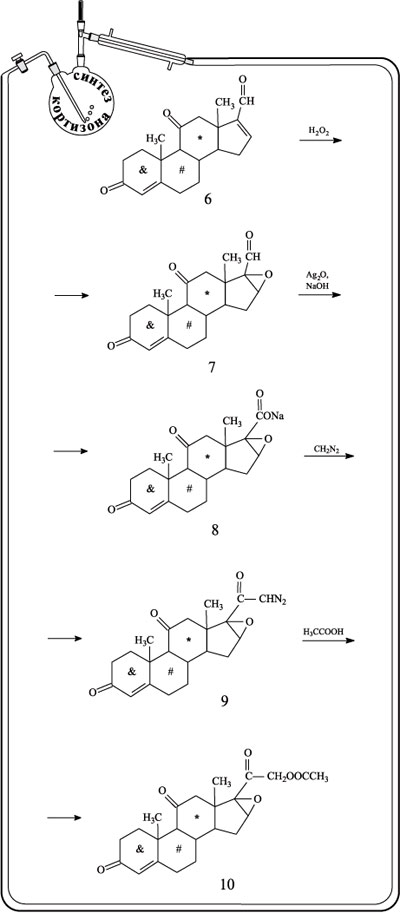
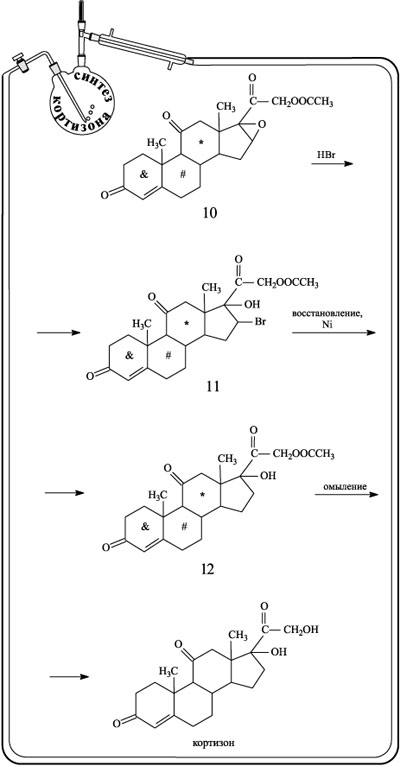
Оксидное кольцо в соединении 10 расщепляли действием HBr, а затем атом Br удаляли восстановлением в присутствии никеля (продукт реакции – вещество 12). На последней стадии проводили омыление ацетатной группы. В результате был получен кортизон.
При получении холестерина и кортизона помимо перечисленных стадий на некоторых этапах необходимо было проводить разделение образующихся изомеров. Таким образом, суммарно эти синтезы были намного более сложными и трудоемкими, чем следует из показанных схем.
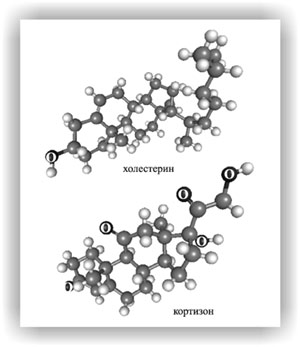
При изображении структур холестерина и кортизона в форме объемных моделей отчетливо видно, что они не плоские. Отдельные циклические фрагменты этих соединений определенным образом изогнуты, что диктуется направлением валентных связей у атомов углерода.
Синтез холестерина и кортизона Вудворд завершил в 1951 г.
Синтез стрихнина
Стрихнин относится к классу органических соединений, называемых алкалоидами. В отличие от стероидов алкалоиды не имеют общих структурных признаков, т.е. у них нет какого-то конкретного фрагмента, общего для всего класса соединений (у стероидов это стеран). В соответствии с современным определением алкалоиды – это азотсодержащие органические основания, встречающиеся в растениях и обладающие физиологической активностью. К настоящему времени из растений выделено более 6000 алкалоидов, большинство из них обладает биологической активностью и используется в медицине. Если учесть, что во всем мире произрастает более 200 тысяч растений, то становится понятным многообразие химии алкалоидов.
Впервые стрихнин был выделен из семян тропического растения – чилибухи, произрастающей на Филиппинах и в Индонезии. В малых дозах (менее 0,01 г) он возбуждает дыхательные и сосудодвигательные центры, тонизирует скелетную мускулатуру, в медицине его применяют как стимулятор центральной нервной системы. В укрупненных дозах (свыше 0,03 г) стрихнин поражает в первую очередь спинной мозг, затем центральную нервную систему, зрение, слух и обоняние, вызывает судороги всех мышц и смерть от удушья (упоминание о стрихнине можно часто встретить в романах А.Дюма, где различные персонажи использовали его в качестве сильнодействующего яда).
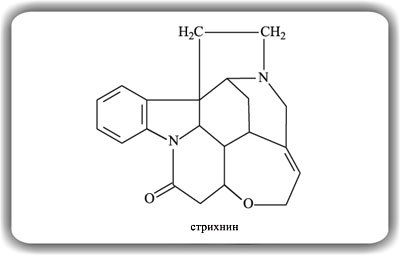
Молекула стрихнина содержит семь циклов, как бы спаянных воедино. Строение стрихнина установил в 1946 г. Р.Робинсон (лауреат Нобелевской премии по химии 1947 г.).
Для того чтобы было удобнее следить за этапами синтеза, мы будем отмечать циклические фрагменты стрихнина буквами А, Б, В, Г и т. д.
Приступая к синтезу стрихнина, Р.Вудворд использовал реакцию, носящую имя своего создателя Э.Фишера. Проведя на первой стадии конденсацию фенилгидразина 1 с ароматическим кетоном 2 и выполнив конденсацию промежуточного соединения 3, он получил замещенный индол 4 (превращение 3 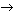 4 и есть реакция Фишера). Индол представляет собой бензольное ядро А, спаянное с пятичленным азотсодержащим гетероциклом Б (на схеме фрагмент индола обведен пунктирной линией). При обработке соединения 4 формальдегидом и диметиламином образуется аминосодержащее производное 5, которое с йодистым метилом дает соль четвертичного аммония 6. При взаимодействии соли 6 с цианидом натрия в диметилформамиде возникает нитрильное производное 7 – соединение, содержащее группу C
4 и есть реакция Фишера). Индол представляет собой бензольное ядро А, спаянное с пятичленным азотсодержащим гетероциклом Б (на схеме фрагмент индола обведен пунктирной линией). При обработке соединения 4 формальдегидом и диметиламином образуется аминосодержащее производное 5, которое с йодистым метилом дает соль четвертичного аммония 6. При взаимодействии соли 6 с цианидом натрия в диметилформамиде возникает нитрильное производное 7 – соединение, содержащее группу C N.
N.
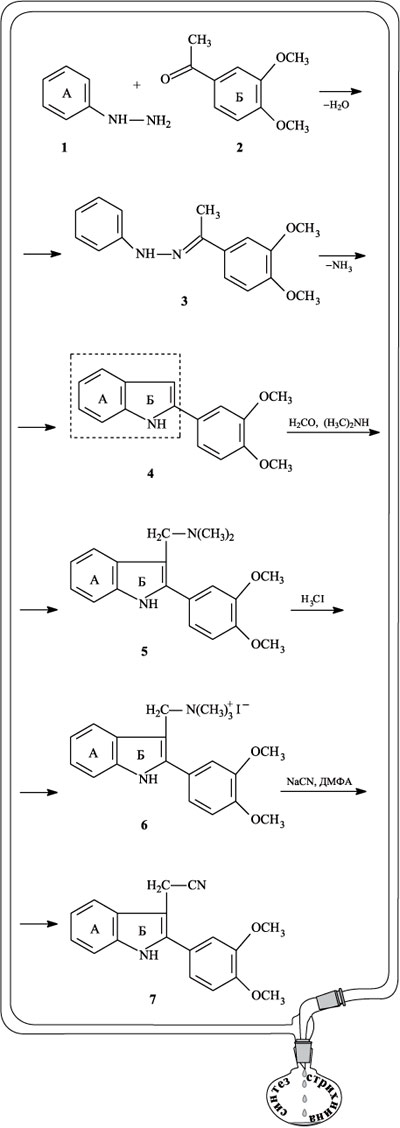
При действии алюмогидрида лития LiAlH4 нитрильная группа восстанавливается до аминной (амин 8). В отличие от соединения 5 аминная группа в амине 8 отделена от индольного фрагмента не одной, а двумя метиленовыми группами СН2. Полученная аминная группа далее взаимодействует с этиловым эфиром глиоксалевой кислоты. Возникает фрагмент N=CH (вещество 9). При действии на этот фрагмент толуолсульфохлоридом ClSO2С6H4СH3 двойная связь в N=CH раскрывается с замыканием нового циклического фрагмента, обозначенного буквой В, двойная связь в индольном фрагменте Б перемещается (теперь это уже индолениновый фрагмент), образуется соединение 10.
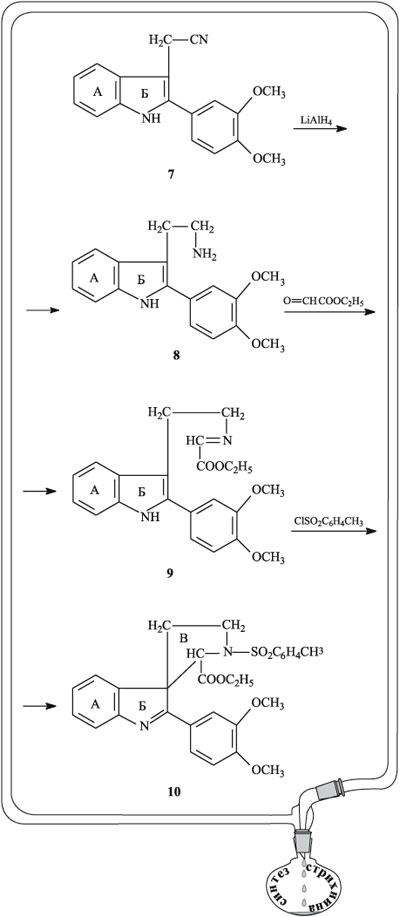
Двойную связь в индолениновом фрагменте гидрируют действием боргидрида натрия NaBH4 и к атому азота в этом фрагменте присоединяют ацетильную группу С(О)СН3 с образованием соединения 11. Соединение 11 озонируют, при этом раскрывается бензольный цикл, содержащий две метоксигруппы (они превращаются в сложноэфирные). При раскрытии бензольного кольца возникают молекулы с двумя конфигурациями, в которых сложноэфирные группы направлены либо в одну сторону (изомер 12), либо в противоположные (изомер 13). В целях наглядности обе конфигурации обведены пунктирной рамкой. Для дальнейших превращений было взято соединение 13. При обработке соединения 13 раствором HCl в метаноле фрагмент SO2С6H4СH3 отщепляется, сложноэфирные группы превращаются в карбоксильные С(О)ОН. Главная особенность этой стадии – замыкание нового цикла, обозначенного буквой Г (это, возможно, наиболее эффектный этап во всей цепочке синтеза), возникает соединение 14.
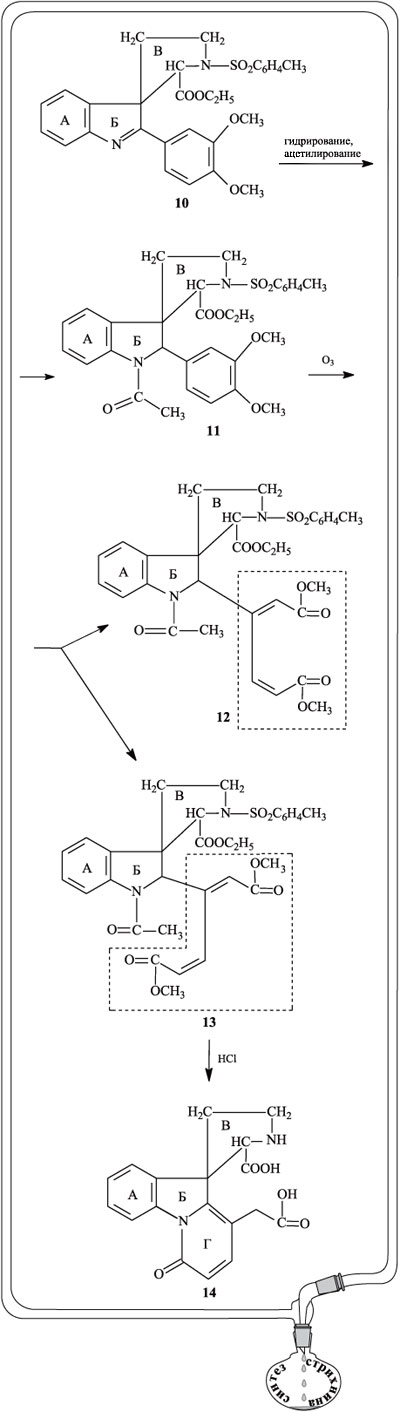
Иминный азот цикла В в соединении 14 ацетилировали, а две присутствующие карбоксильные группы вновь метилировали (продукт реакции 15). При действии на 15 метилатом натрия протекает сложноэфирная конденсация и замыкается очередной цикл, обозначенный буквой Д (соединение 16).
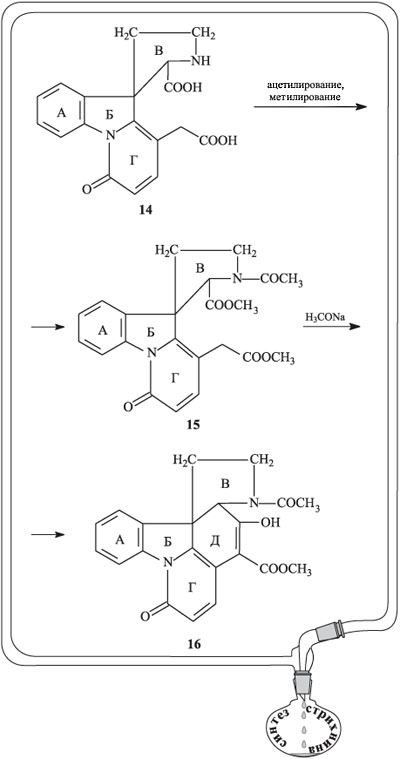
Дальнейшие действия были направлены на то, чтобы удалить из цикла Д группу ОН и двойную связь. Группу ОН этерифицировали действием толуолсульфохлорида в присутствии пиридина (соединение 17), а затем замещали на сульфидную группу с помощью натриевой соли бензилмеркаптана NaS–CH2–С6Н5 (соединение 18).
Гидрированием соединения 18 на никелевом катализаторе удалили сульфидную группу и получили вещество 19. Гидрирование на палладиевом катализаторе протекает по двойной связи в цикле Д, сложноэфирная группа при этом превращается в карбоксильную, продукт реакции – соединение 20.
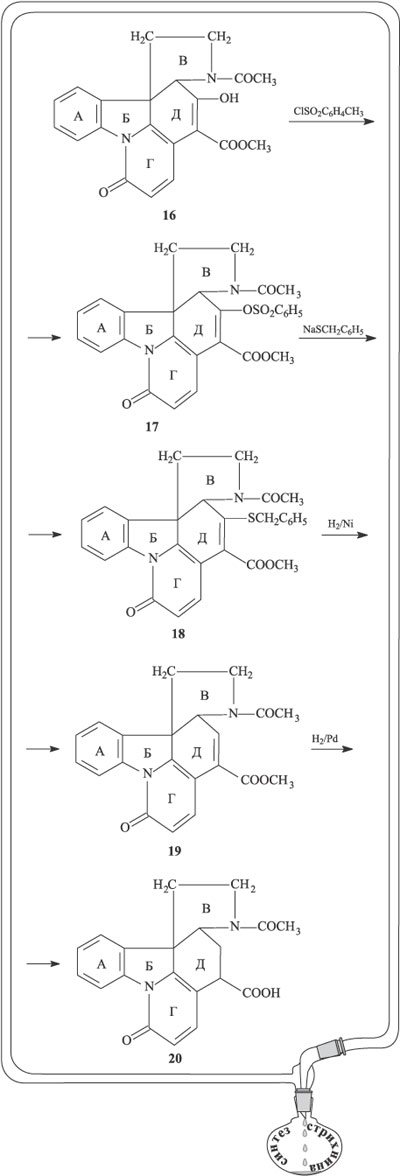
На следующем этапе происходит образование очередного циклического фрагмента. Сначала карбоксильную группу, связанную с циклом Д, превращают в кетонную (соединение 21), затем кислотным гидролизом отщепляют ацетильную группу от атома азота (соединение 22). Окислительная циклизация по метильной группе ацетильного фрагмента при цикле D и атому азота цикла В в присутствии диоксида селена SeO2 дает новый цикл Е, содержащий две кетогруппы (соединение 23).
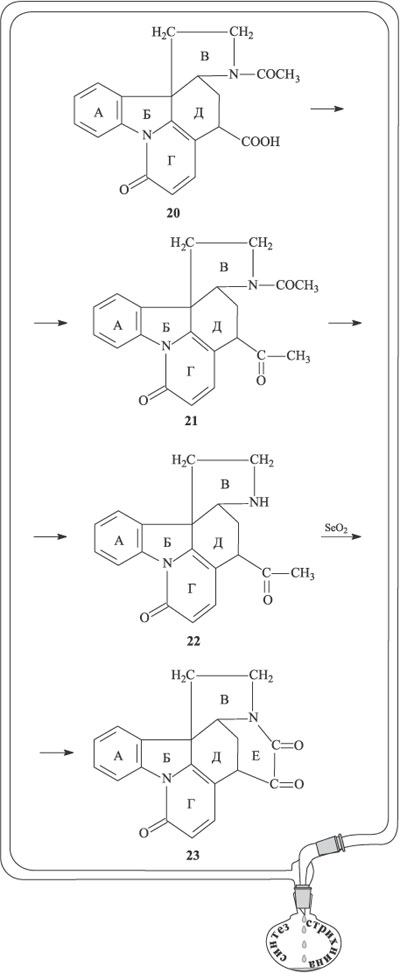
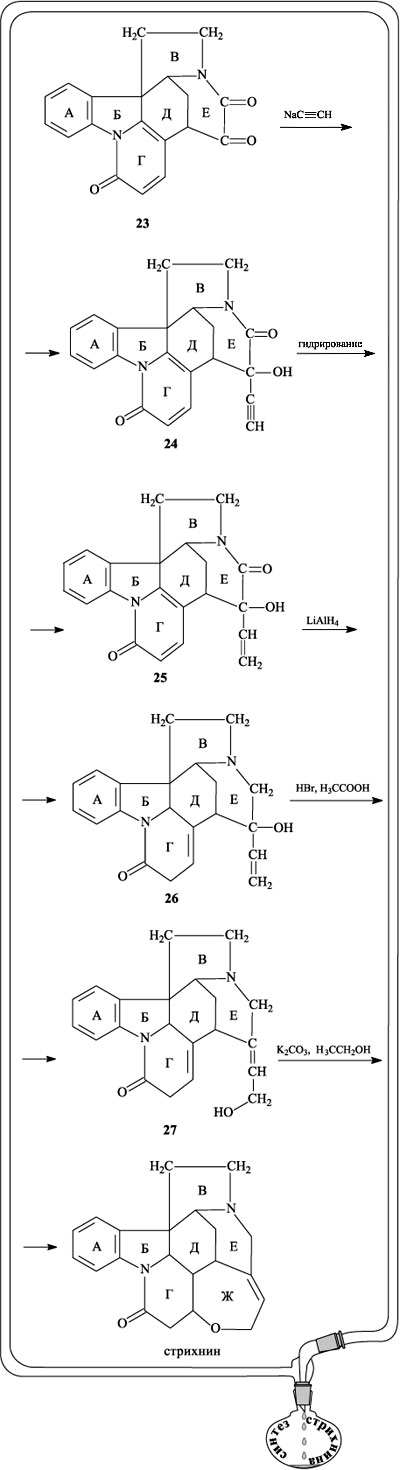
Теперь уже очертания будущей молекулы стрихнина стали отчетливо вырисовываться, необходимо было лишь замкнуть последний цикл, что и было проделано на завершающем отрезке пути. При взаимодействии вещества 23 с ацетиленидом натрия одна из карбонильных групп в цикле Е превращается в группу ОН и возникает фрагмент этинилкарбинола НС С–ОН (вещество 24). Частичное гидрирование тройной связи приводит к соединению 25. При действии алюмогидрида лития кето-группа С=О, входящая в состав цикла Е, восстанавливается до СН2, одновременно происходит частичное гидрирование цикла Г и перемещение кратных связей (соединение 26). При обработке 26 бромидом водорода в уксусной кислоте фрагмент цикла Е перегруппировывается, в нем происходит перемещение ОН-группы и двойной связи (продукт реакции 27). На последней стадии (в присутствии карбоната калия и этанола) ОН-группа боковой цепи цикла Е присоединяется по двойной связи цикла Г, в итоге образуется стрихнин.
С–ОН (вещество 24). Частичное гидрирование тройной связи приводит к соединению 25. При действии алюмогидрида лития кето-группа С=О, входящая в состав цикла Е, восстанавливается до СН2, одновременно происходит частичное гидрирование цикла Г и перемещение кратных связей (соединение 26). При обработке 26 бромидом водорода в уксусной кислоте фрагмент цикла Е перегруппировывается, в нем происходит перемещение ОН-группы и двойной связи (продукт реакции 27). На последней стадии (в присутствии карбоната калия и этанола) ОН-группа боковой цепи цикла Е присоединяется по двойной связи цикла Г, в итоге образуется стрихнин.
Естественно, что молекула, содержащая шесть конденсированных неароматических циклов, не может быть плоской. Тетраэдрическая направленность валентностей атомов углерода приводит к тому, что все циклические фрагменты, за исключением фенильного кольца, определенным образом изгибаются, это отчетливо видно при объемном изображении молекулы стрихнина (атомы водорода не показаны):
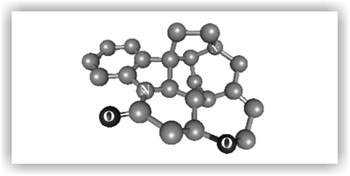
Синтез стрихнина Вудворд завершил в 1954 г.
Все три рассмотренных синтеза продемонстрировали могущество органического синтеза, а также необычайно точное стратегическое мастерство автора, сумевшего от начала до конца спланировать все цепочки превращений до того, как была начата синтетическая работа. Не менее важный результат заключался в том, что было надежно подтверждено установленное ранее строение этих соединений.
Дело в том, что все три полученных соединения – холестерин, кортизон и стрихнин – по всем показателям (внешний вид, цвет, температура плавления, химические свойства и др.) оказались полностью идентичны природным продуктам. В те годы, когда проводились эти синтезы, современные спектральные методы доказательства строения только начинали развиваться. Начиная с середины XIX в. и до 50-х гг. ХХ в. наиболее надежным доказательством строения органических соединений был метод «встречного синтеза». Смысл этого метода состоит в следующем: одно и то же соединение, полученное двумя принципиально различными путями, должно иметь одинаковые физические и химические свойства. В рассмотренных нами случаях Вудворд проводил встречный синтез, как бы соревнуясь с самой Природой. Кстати, Вудворд был одним из тех химиков, которые довольно быстро оценили возможности спектральных методов при изучении строения вещества.
Синтезы Вудворда произвели сильное впечатление на химиков всего мира. Некоторые химики-синтетики, желая продемонстрировать свое умение продумывать «многоходовые шахматно-химические партии» (термин Вудворда), а также стараясь показать экспериментальное мастерство, вступили как бы в заочное состязание с Вудвордом. Синтез кортизона выполнили: в 1952 г. Л.Ш.Саретт (Канада), позже – в 1986 г. И.Куваима и в 1990 г. К.Фукумото (оба – Япония), каждый своим оригинальным способом. Стрихнин, помимо Вудворда, удалось получить только Л.Е.Оверману (США) в 1993 г. по принципиально иной методике.
Синтезы холестерина, кортизона и стрихнина вошли в современные учебники органической химии как классические образцы, демонстрирующие неисчерпаемые возможности органического синтеза.
На этом успехи Вудворда не закончились, впереди были еще более значительные достижения – синтез хлорофилла (в течение четырех лет), а также синтез витамина В12, который продолжался 11 лет и был осуществлен с участием более чем 90 специалистов из 19 стран. Об этих работах мы непременно расскажем в рубрике «Летопись важнейших открытий».
* * *
 ВУДВОРД Роберт Бернс (10.IV.1917–8.VII.1979) родился в штате Массачусетс США. Его родители имели шотландские корни, по преданию мать происходила из рода известного английского поэта Роберта Бернса, о чем напоминает имя Вудворда.
ВУДВОРД Роберт Бернс (10.IV.1917–8.VII.1979) родился в штате Массачусетс США. Его родители имели шотландские корни, по преданию мать происходила из рода известного английского поэта Роберта Бернса, о чем напоминает имя Вудворда.
В возрасте десяти лет он устроил химическую лабораторию в подвале своего дома и к двенадцати годам проделал все опыты, описанные в классическом пособии Л.Гаттермана «Практические методы органической химии». Уже в 12 лет он разработал способ синтеза хинина, что и осуществил много лет спустя, но уже, естественно, совсем иным путем. В шестнадцатилетнем возрасте Вудворд поступил в Массачусетсский технологический институт, в это время его знания органической химии были близки к тем, которые имели выпускники института.
В 17 лет он опубликовал первую научную работу, а в 20 лет получил ученую степень. В 1936 г. Вудворд закончил обучение в Массачусетсском технологическом институте и с 1937 г. работал в Гарвардском университете, где в 1950 г. получил звание профессора. Известность принес ему синтез хинина, получение которого (совместно с У.Э.Дерингом) он закончил в 1944 г. после 14 месяцев работы. В этом процессе использовалось 17 стадий для создания остова молекулы и, кроме того, много дополнительных этапов, позволивших ввести необходимые функциональные группы.
Уникальные синтезы следуют один за другим. В 1950 г. он осуществил полный синтез важного антибиотика патулина. Эти работы создали биогенетическую теорию индольных алкалоидов. В это же время его внимание начинает привлекать химия стероидов. В течение 1951 г. он сообщил о синтезах холестерина и кортизона. Прошло всего три года, и в 1954 г. Вудворд сообщил о завершении еще трех крупных синтезов: ланостерина — стероида, присутствующего совместно с холестерином в жире овец, лизергиновой кислоты и стрихнина. Еще через два года был закончен синтез резерпина — алкалоида, применяемого для лечения нервных заболеваний и гипертонии. В 1960 г. искусство Вудворда как химика-синтетика достигло еще больших высот, он завершил начатый в 1956 г. полный синтез хлорофилла (зеленое вещество листьев растений, осуществляющее фотосинтез). Вудворду и его семнадцати сотрудникам потребовалось более 20 стадий для получения этого вещества. Чтобы более полно представить всю уникальность проделанной работы, отметим, что известный немецкий химик-органик, лауреат Нобелевской премии 1930 г. Г.Фишер на расшифровку структуры хлорофилла затратил 10 лет (1930—1940 гг.). Прошло еще два года с того времени, когда был синтезирован хлорофилл, и мир узнал о новом достижении Вудворда — он синтезировал антибиотик тетрациклин.
С 1963 г. Вудворд руководил в Базеле (Швейцария) работой института, который был основан специально для него и стал называться Вудвордовским институтом. Пост директора этого института он совмещал с работой в Гарвардском университете.
В 1963 г. был закончен сложнейший синтез алкалоида колхицина, а в 1965 г. он получил цефалоспорин (соединение из группы пенициллинов).
В 1965 г. Вудворд был удостоен Нобелевской премии «За выдающийся вклад в искусство органического синтеза». На церемонии вручения Вудворду премии профессор А.Фредга оценил его работу в органической химии следующими словами: «Иногда говорят, что органический синтез представляет собой одновременно точную науку и изящное искусство. Здесь неоспоримый мастер – Природа. Но я осмелюсь утверждать, что лауреат премии нынешнего года доктор Вудворд по праву занимает второе место».
После получения премии в Стокгольме Вудворд сказал: «Я почти не сомневаюсь, что можно создать в лабораторных условиях Нечто с характерными признаками жизни. Но я не хотел бы предсказывать, сколько на это потребуется времени».
В 1972 г. научный мир познакомился с еще одной сенсацией: Вудворд закончил начатый в 1961 г. полный синтез витамина В12 – сложного комплексного соединения порфиринового ряда, содержащего кобальт и имеющего относительную молекулярную массу 1357. Научная общественность сочла это высшим достижением во всей истории органической химии. Его работа, описывающая синтез эритромицина, была опубликована уже после смерти Вудворда, в 1980 г.
Вудворд сумел по-новому осмыслить тот процесс, с помощью которого химик осуществляет синтез новых соединений. Он показал, как можно проводить синтезы сложнейших природных соединений, расходуя меньше времени и сил. Он научил химиков-органиков по-новому думать. Вудворд считал, что химический синтез – это творческий процесс, в котором основную роль играют искусство, замысел, воображение и вдохновение. Сама природа химического синтеза постадийная и потому требует строго мышления и тщательного планирования. Особого мастерства достиг Вудворд в своем умении создавать и в нужный момент разрушать циклические фрагменты. Освоив стиль мышления Вудворда, многие высококвалифицированные химики смогли также проводить удивительные по сложности замысла синтезы, ранее казавшиеся неосуществимыми. Однако даже те, кто овладел его методом, не могли состязаться с Вудвордом, которого отличал особо элегантный стиль работы, присущий только ему.
Вудворд также сумел сказать решающее слово в области, непосредственно не связанной с его научными интересами. В 1952 г. он, пользуясь весьма скромными экспериментальными данными, определил структуру ферроцена (бициклопентадиенилжелеза). Молекула ферроцена представляет собой сандвич, в котором атом железа зажат между двумя плоскими органическими циклами (ранее такие молекулы не были известны). Вудворд предложил название этому соединению, доказал его ароматичность и фактически открыл дорогу принципиально новому направлению – химии комплексов переходных металлов.
Наряду с уникальным экспериментальным даром Вудворд обладал талантом теоретика. Его работы, рассматривающие механизмы стереоспецифических реакций, глубоко повлияли на стиль мышления современных химиков-органиков. Вудворд внес ощутимый вклад в познание структур многочисленных природных веществ. В 1965 г. он совместно с Р.Хофманом сформулировал правила сохранения орбитальной симметрии. Эти правила указывают, «как разрешается сдвигаться электронной плотности» в процессе образования тех или иных химических связей. В результате этой работы теория молекулярных орбиталей стала практическим инструментом органической химии, удалось систематизировать громадный массив химических знаний и предсказать новые результаты.
Вудворд был замечательным педагогом, он создал огромную школу учеников – более чем из трехсот химиков Кембриджа, Базеля и Цюриха. С 1948 г. его постоянно приглашают читать лекции во многие страны Европы. Лорд Тодд вспоминал: «Одной из наиболее удивительных черт Р.Вудворда была его способность заражать молодых химиков своей страстью к органической химии… Разумеется, он был блестящий лектор! Он всегда точно укладывался во время, при нем всегда была его знаменитая коробочка с цветными мелками и специальная тряпка для стирания с доски». Лекция, посвященная синтезу конкретного соединения, начиналась рисунком в верхней левой части доски и заканчивалась в нижнем правом углу. Вся доска оказывалась заполненной изящно нарисованными цветными формулами, как бы уже готовыми для фотографирования и последующей публикации. По воспоминаниям некоторых очевидцев, Вудворд мог рисовать на доске сложнейшие структуры и схемы одновременно двумя руками таким образом, что все в конечном итоге точно сходилось в единый рисунок.
Его лаборатория постоянно была центром притяжения химиков-органиков всего мира. На еженедельных семинарах заслушивался доклад одного из диссертантов, затем присутствующим предлагалось решить проблему, которая возникала перед диссертантом в процессе работы. В конце обсуждения выступал сам Вудворд и, как всегда, предлагал наилучшее решение. О своих учениках он говорил: «Люди, которые прошли нашу школу, способны выполнить любое задание на самом высоком уровне». Среди наиболее талантливых учеников и последователей Вудворда следует отметить американского химика Э.Дж.Кори, получившего в 1990 г. Нобелевскую премию за развитие теории и методов органического синтеза. Идеи и стиль работы Вудворда продолжают жить в работах его учеников.
М.М.ЛЕВИЦКИЙ
© "Первое сентября", начало + окончание













